Właściwości związków manganu – najważniejsze reakcje
Mangan jest metalem znajdującym się w bloku d, należącym do metali przejściowych.
Metale przejściowe to takie, które mają niecałkowicie zapełnioną podpowłokę d. W przypadku zarówno atomu Mn jak i jonu Mn2+ podpowłoka 3d nie jest zapełniona całkowicie.
Mangan jest metalem, który występuje na wielu różnych stopniach utlenienia.
Najtrwalszym stopniem utlenienia manganu jest +II np. w solach tj. MnCl2, MnSO4, Mn(NO3)2 itd.
Mangan występuje również na + IV stopniu utlenienia np. w MnO2, na +VI stopniu utlenienia w K2MnO4 czy na +VII stopniu utlenienia w popularnym utleniaczu KMnO4.
Właściwości związków manganu są ściśle związane ze stopniem utlenienia, na którym mangan w nich występuje. Prezentuje to poniższa tabela.
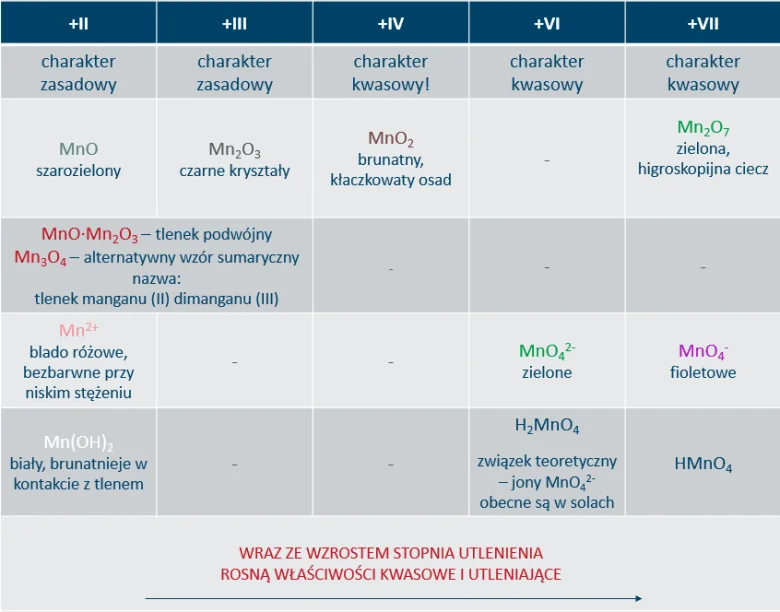
Najważniejsze reakcje związków manganu:
Otrzymywanie manganu
3Mn3O4 + 8Al ⟶ 9Mn + 4Al2O3
Reakcja manganu z kwasami
Mn + 2HCl ⟶ MnCl2 + H2
Reakcja tlenku manganu(IV) z kwasami
MnO2 + 4HCl ⟶ MnCl2 + Cl2 + 2H2O
MnO2 + H2SO4 ⟶ MnSO4 + ½ O2 + H2O
Reakcja tlenku manganu(IV) z nadtlenkiem wodoru w środowisku kwasowym
MnO2 + H2O2 + H2SO4 → MnSO4 + O2 + 2H2O
Reakcja otrzymywania tlenku manganu(III)
4MnO2 –T→ 2Mn2O3 + O2
Otrzymywanie manganianu(VI) potasu
2MnO2 + 4KOH + O2 → 2K2MnO4 + 2H2O
Tlenek manganu (IV) reaguje z tlenem w środowisku zasadowym w wyniku czego powstają sole manganu (VI).
Otrzymywanie kwasu manganowego(VII)
Mn2O7 + H2O → 2HMnO4
Termiczny rozkład manganianu(VII) potasu – laboratoryjna metoda otrzymywania tlenu
2KMnO4 → K2MnO4 + MnO2 + O2
Reakcja manganianu(VII) potasu z kwasem solnym – laboratoryjna metoda otrzymywania chloru
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Dysproporcjonowanie manganianu(VI) potasu
3K2MnO4 + 4HCl → 2KMnO4 + MnO2 + 4KCl + 2H2O
3K2MnO4 + 2H2O → 2KMnO4 + MnO2 + 4KOH
Manganiany(VI) są trwałe w środowisku silnie zasadowym. W środowisku kwasowym i obojętnym są związkami nietrwałymi i ulegają dysproporcjonowaniu do manganianów(VII) oraz tlenku manganu(IV).
Redukcja manganianu(VI) potasu (środowisko zasadowe)
K2MnO4 + H2O2 → MnO2 + O2 + 2KOH
Reakcja wodorotlenku manganu(II) z tlenem
2Mn(OH)2 + O2 → 2MnO2 · H2O
Biały wodorotlenek manganu(II) pod wpływem tlenu np. z powietrza brunatnieje – przechodzi w uwodniony tlenek manganu(IV).
Subskrybuj nasz kurs online, aby uzyskać dostęp do pełnej treści lekcji.
Jeśli jeszcze nie potrzebujesz subskrypcji, sprawdź koniecznie nasze przykładowe lekcje dostępne zupełnie za darmo!


