Właściwości związków żelaza – tlenki, wodorotlenki i sole
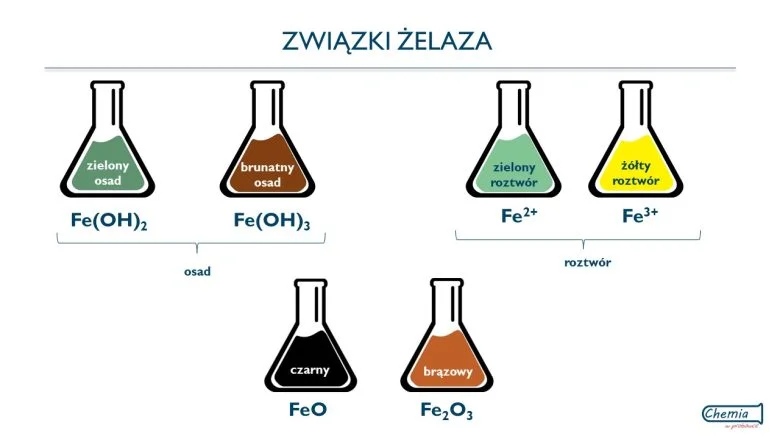
Żelazo tworzy tlenki i wodorotlenki, których wzory i barwy przedstawiłam w poniższej tabeli. Warto także pamiętać o barwach roztworów wodnych soli żelaza.
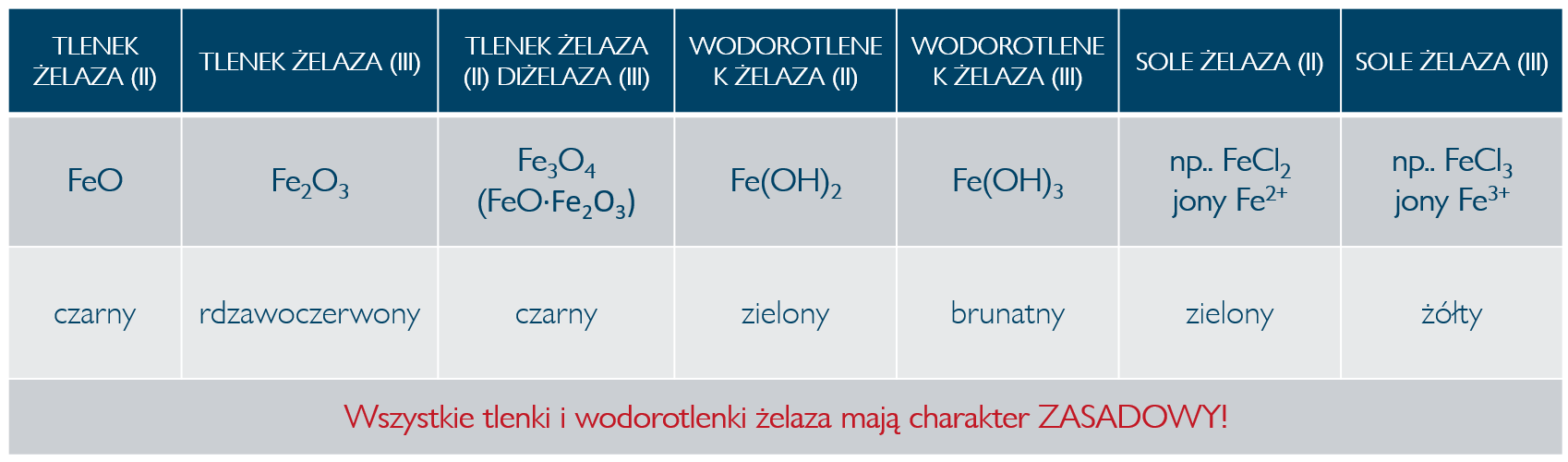
Wbrew powszechnej opinii tlenki i wodorotlenki żelaza mają charakter zasadowy, a nie amfoteryczny. Potwierdzają to doświadczenia z zasadami. Ani tlenki ani wodorotlenki żelaza zarówno na +II, jak i +III stopniu utlenienia nie roztwarzają się w zasadach w temperaturze pokojowej. Jedynie ze stężonym roztworem KOH w wysokiej temperaturze można zaobserwować częściowe roztwarzanie. Jednak większość doświadczeń opisywanych w zadaniach maturalnych przebiegają w temperaturze pokojowej!
Otrzymywanie tlenków żelaza
3Fe + 2O2 → Fe3O4
3Fe + 4H2O –T→ Fe3O4 + 4H2
FeCO3 –ogrzewanie→ FeO + CO2
2Fe(OH)3 –ogrzewanie→ Fe2O3 + 3H2O
Otrzymywanie wodorotlenków żelaza
Przykładowe reakcje strącania:
FeBr2 + 2KOH → Fe(OH)2 + 2KBr
FeBr3 + 3KOH → Fe(OH)3 + 3KBr
Utlenianie wodorotlenku żelaza (II) do wodorotlenku żelaza (III)
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
2Fe(OH)2 + H2O2 → 2Fe(OH)3
Wodorotlenek żelaza (II) szybko utlenia się pod wpływem np. tlenu zawartego w powietrzu lub roztworu H2O2 Produktem tej reakcji jest wodorotlenek żelaza (III). Podczas reakcji obserwujemy zmianę barwy osadu z zielonej na brunatną.
W podobny sposób mogą utleniać się jony Fe2+ do jonów Fe3+, których źródłem są sole rozpuszczalne w wodzie. Reakcja zachodzi w kwasowym środowisku.
4Fe2+ + O2 + 4H+→ 4Fe3+ + 2H2O
Subskrybuj nasz kurs online, aby uzyskać dostęp do pełnej treści lekcji.
Jeśli jeszcze nie potrzebujesz subskrypcji, sprawdź koniecznie nasze przykładowe lekcje dostępne zupełnie za darmo!
Zadania
Według badań przećwiczenie materiału od razu w praktyce poprawia zapamiętywanie o 30%!
Poziom trudności tego zadania to 4/6
Poziom trudności określa, jak trudne jest zadanie:
0-2: Zadania bardzo łatwe, mają za zadanie wprowadzić Cię w temat.
3-4: Jest to poziom odpowiadający łatwiejszym zadaniom na maturze.
5-6: Jest to poziom odpowiadający trudniejszym zadaniom na maturze.

