Stan równowagi chemicznej hydrolizy estru
Do kolby kulistej wprowadzono 2 mole pewnego ciekłego estru R1COOR2, 2 mole wody i 1 mol bezwodnego ciekłego kwasu karboksylowego R1COOH. Naczynie zamknięto korkiem z osadzoną chłodnicą zwrotną i ogrzewano do temperatury T wyższej od temperatury panującej w laboratorium. W kolbie zachodził proces opisany równaniem:
R1COOR2 (c) + H2O (c) ⇔ R1COOH (c) + R2OH (c)
Reakcję przerwano, kiedy w kolbie ustalił się stan równowagi dynamicznej. W warunkach doświadczenia stężeniowa stała równowagi hydrolizy estru R1COOR2 jest równa 1,0.
Oblicz, ile moli alkoholu R2OH znajdowało się w kolbie w momencie osiągnięcia stanu równowagi dynamicznej przez układ.
Obliczenia :
(W kolbie w momencie osiągnięcia stanu równowagi znajdowało się) 0,8 (mola alkoholu R2OH).
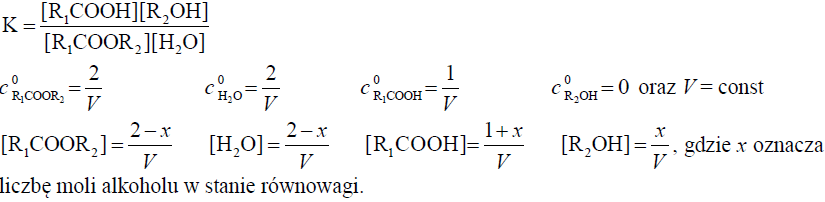

Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


