Miareczkowanie – titrant i masa substancji w analicie
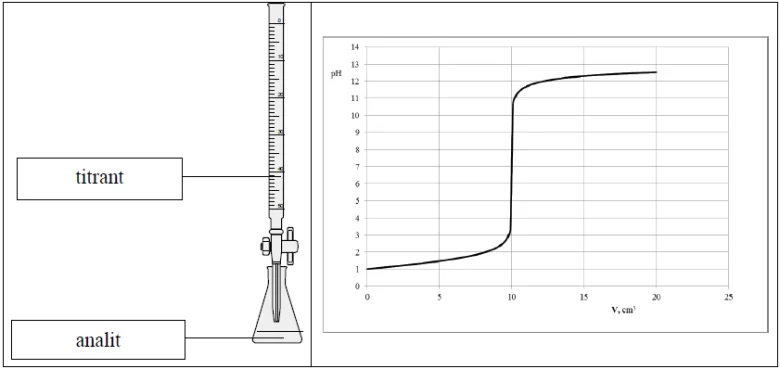
Przeprowadzono doświadczenie, podczas którego do wodnego roztworu mocnego elektrolitu dodawano kroplami wodny roztwór innego mocnego elektrolitu i za pomocą pehametru mierzono pH mieszaniny reakcyjnej. Przebieg doświadczeń zilustrowano poniższym schematem.
Opisane doświadczenie jest przykładem miareczkowania alkacymetrycznego (kwasowo- -zasadowego), które polega na dodawaniu z biurety roztworu, nazywanego titrantem, do kolby z próbką, nazywaną analitem. W miareczkowaniu wykorzystuje się stechiometryczną zależność między analitem i titrantem.
Dany jest zestaw elektrolitów o wzorach:
HCOOH HCl NH3 · H2O NaOH CH3COOH
Do 10 cm3 analitu dodawano kroplami titrant o stężeniu 0,1 mol · dm–3.
a) Z wykresu umieszczonego w informacji odczytaj objętość titranta potrzebną do zobojętnienia analitu oraz podaj stężenie molowe analitu.
Objętość titranta: ..........................................................................................................................
Stężenie molowe analitu: .............................................................................................................
b) Oblicz masę substancji w analicie.
a) Objętość titranta: V = 10 cm3
Stężenie molowe analitu: cm = 0,1 mol·dm–3
b) cm = 0,1 mol·dm–3 i V = 10 cm3 = 0,01 dm3 ⇒ n = cm · V = 0,001 mola
m = n · M = 0,001 mola · 36,5 g ·mol–1 = 0,0365 g
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.