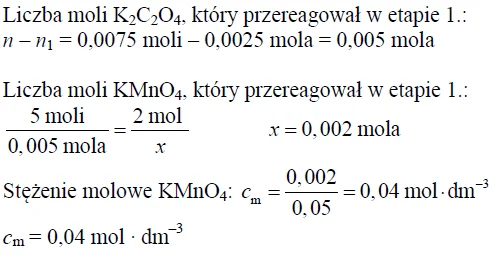Miareczkowanie kwasu szczawiowego
Do kolby stożkowej zawierającej 50 cm3 wodnego roztworu manganianu(VII) potasu o nieznanym stężeniu dodano 30 cm3 wodnego roztworu szczawianu potasu (K2C2O4) o stężeniu 0,25 mol · dm–3 (etap 1.). Przebiegła reakcja opisana równaniem:
5C2O42–+2MnO4–+ 16H+→ 10CO2 +2Mn2++ 8H2O
Po pewnym czasie roztwór się odbarwił. Następnie, w celu usunięcia pozostałej ilości szczawianu potasu, do tej mieszaniny dodano 30 cm3 wodnego roztworu azotanu(V) wapnia o stężeniu 0,1 mol · dm–3 (etap 2.). Przebiegła reakcja opisana równaniem:
C2O42– + Ca2+→CaC2O4
Wytrącony osad odsączono, wysuszono i zważono. Jego masa była równa 0,32 g.
Oblicz stężenie molowe manganianu(VII) potasu w badanej próbce.
Obliczenia: