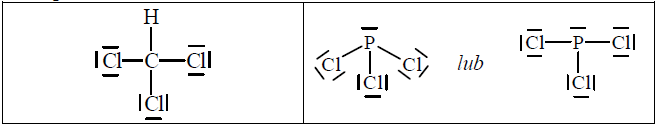
Wzory elektronowe i wiązanie koordynacyjne
Chloroform (trichlorometan) o wzorze CHCl3 i trichlorek fosforu o wzorze PCl3 są związkami kowalencyjnymi.
a) Określ kształt cząsteczki chloroformu (cząsteczka tetraedryczna, płaska, liniowa).
......................................................................................................................................................
b) Narysuj wzór elektronowy cząsteczki CHCl3 oraz wzór elektronowy cząsteczki PCl3 – zaznacz kreskami wiązania chemiczne oraz wolne pary elektronowe.
c) Oceń, czy atom centralny w cząsteczce chloroformu i w cząsteczce trichlorku fosforu może tworzyć wiązanie koordynacyjne. Odpowiedź uzasadnij.
Chloroform:..............................................................................................................................................................................................................................................................................................................................................
Trichlorek fosforu ..................................................................................................................................................................................................................................................................................................................................................................
a)(cząsteczka) tetraedryczna
c) Chloroform: Atom centralny w cząsteczce chloroformu nie może tworzyć wiązania koordynacyjnego, ponieważ nie dysponuje wolną parą elektronową (i osiągnął oktet elektronowy).
Trichlorek fosforu: Atom centralny w cząsteczce trichlorku fosforu może tworzyć wiązanie koordynacyjne, ponieważ ma wolną parę elektronową.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.