Kwas ortobromowy
Kwas ortoborowy H3BO3 jest bardzo słabym jednoprotonowym kwasem, który w roztworach wodnych działa nie jako donor protonów, lecz jako akceptor jonów wodorotlenkowych, reagując z wodą zgodnie z równaniem:
H3BO3 + 2H2O ⇔ H3O+ + [B(OH)4]–
Stała równowagi tej reakcji jest równa 5,8 · 10–10.
W obecności środków odciągających wodę, np. stężonego H2SO4, kwas ortoborowy tworzy z alkoholami estry.
Narysuj wzór elektronowy cząsteczki kwasu ortoborowego, oznaczając kreskami wiązania oraz wolne pary elektronowe. Wyjaśnij, dlaczego kwas borowy jest akceptorem jonów wodorotlenkowych.
Wzór:
Wyjaśnienie:
......................................................................................................................................................
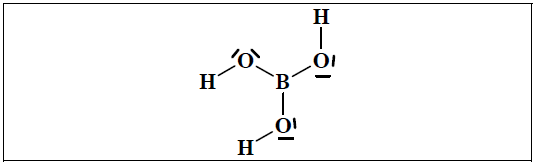 Uwaga: Nie jest wymagane uwzględnienie kątów między wiązaniami.
Uwaga: Nie jest wymagane uwzględnienie kątów między wiązaniami.
Wyjaśnienie:
W cząsteczce kwasu atom boru wykazuje deficyt elektronów (ma 6 elektronów w powłoce walencyjnej, dąży do uzyskania oktetu, dlatego jest akceptorem pary elektronowej jonu OH–).
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


