Redoks na podstawie potencjałów standardowych
Do probówek zawierających zakwaszone roztwory wodne odpowiednio manganianu(VII) potasu (probówka I) i jodku potasu (probówka II) dodano roztwór wodny nadtlenku wodoru. Zaobserwowano zmiany barwy zawartości obu probówek i inne objawy świadczące o przebiegu reakcji chemicznych.
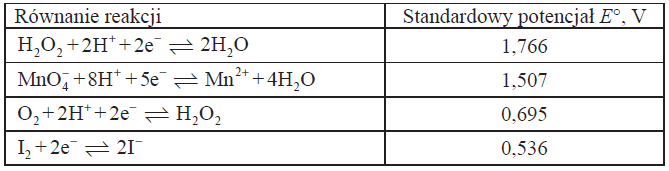
 W tabeli podano wartości standardowych potencjałów wybranych układów redoks.
W tabeli podano wartości standardowych potencjałów wybranych układów redoks.
Napisz w formie jonowej skróconej równania reakcji chemicznych, które przebiegły w probówkach I i II.
Probówka I:
......................................................................................................................................................
Probówka II:
......................................................................................................................................................
Probówka I: 2MnO4– +6H++5H2O2 → 2Mn2+ + 8H2O +5O2
Probówka II: H2O2 + 2H+ + 2I– → I2 +2H2O
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.