Zadanie 6, arkusz czerwiec 2021
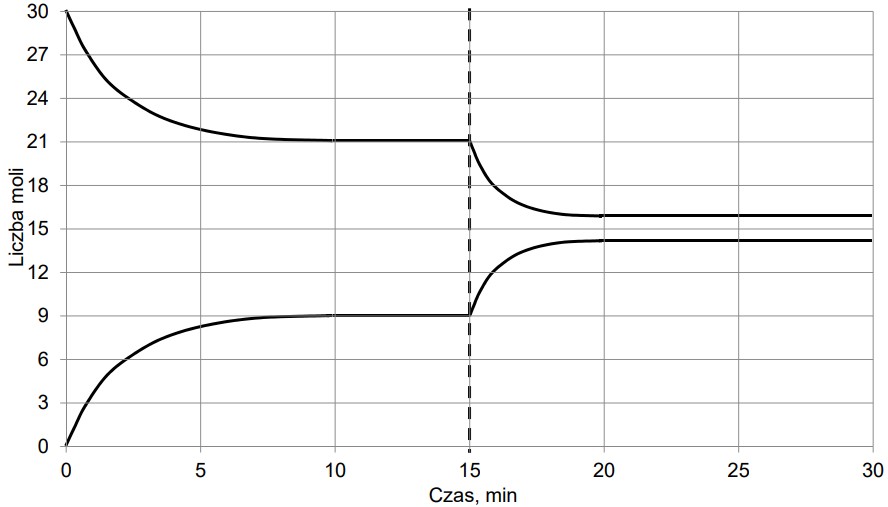
Do reaktora, w którym znajdowała się stała substancja X, wprowadzono pod ciśnieniem atmosferycznym gazową substancję Y i zapoczątkowano reakcję chemiczną, w wyniku której powstawał gaz Z. Po 10 minutach, w temperaturze T1, ustaliła się równowaga opisana równaniem:
X (s) + Y (g) ⇄ Z (g)
Na wykresie przedstawiono wyniki pomiaru liczby moli gazowych reagentów w trakcie trwania procesu oraz po ustaleniu się stanu równowagi w temperaturze T1. W piętnastej minucie eksperymentu zmieniono w układzie temperaturę na T2 wyższą od T1, czego konsekwencją było ustalenie się nowego stanu równowagi po dwudziestu minutach eksperymentu, co także zilustrowano na poniższym wykresie.
Rozstrzygnij, czy w temperaturze T2 – w porównaniu z przemianą zachodzącą w temperaturze T1 – następuje:
• wzrost szybkości reakcji tworzenia substancji Z;
....................................................................................................................................................
• spadek szybkości reakcji rozkładu substancji Z.
....................................................................................................................................................
Odpowiedzi uzasadnij.
....................................................................................................................................................
....................................................................................................................................................
Rozstrzygnięcie:
• wzrost szybkości reakcji tworzenia substancji Z: TAK
• spadek szybkości reakcji rozkładu substancji Z: NIE
Uzasadnienie: W wyższej temperaturze reakcje chemiczne zachodzą szybciej.
ALBO
Wzrost temperatury powoduje wzrost szybkości reakcji zachodzących w obu kierunkach.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.