Aromatyczność kationów
Reguła 4n+2 przewiduje właściwości aromatyczne także dla pierścieni zawierających 2 elektrony
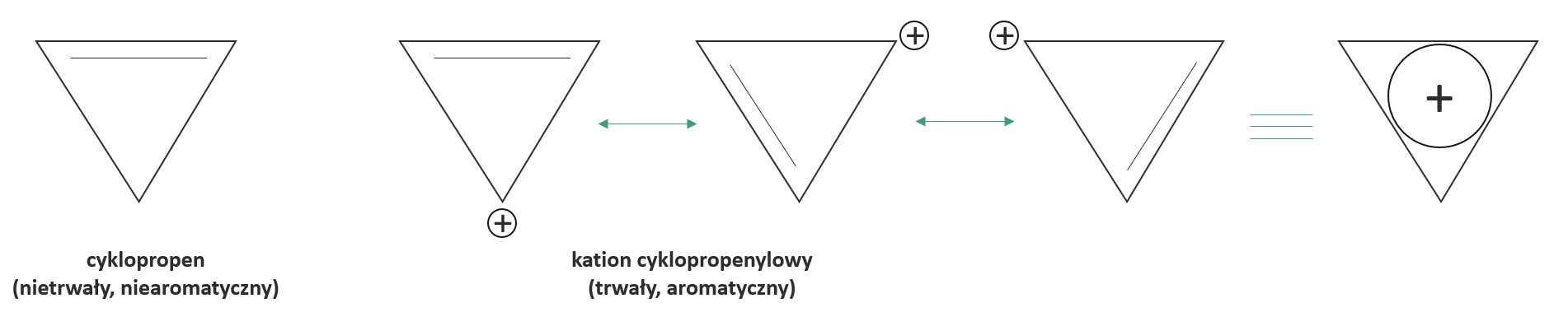
W cyklopropenie wiązanie podwójne musi być zdelokalizowane, ponieważ trzeci atom węgla jest w stanie hybrydyzacji sp3 i nie posiada wolnego orbitalu p, mogącego uczestniczyć w powstawaniu orbitalu molekularnego obejmującego całą cząsteczkę. dodatkowy orbital p pojawia się jednak w kationie cyklopropenylowym i może nakładać się z sąsiednimi orbitalami p tworząc pierścieniowy orbital molekularny, podobnie jak ma to miejsce w cząsteczce benzenu. Różnica polega na tym, że delokalizacji ulegają tylko dwa elektrony i że cała cząsteczka ma ładunek dodatni.
Poniżej przedstawiono struktury graniczne, które pokazują, że ładunek dodatni w kationie cyklopropenylowym jest rozproszony równomiernie na wszystkie trzy atomy węgla.
źródło: P. Mastalerz, Chemia organiczna, PWN, Warszawa 1986
Określ, czy cyklohepta-1,3,5-trien (tropyliden) oraz kation tropyliowy mają właściwości aromatyczne.
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!
Cykloheptatrien, mimo iż spełnia regułę 4n+2, nie jest związkiem aromatycznym, ponieważ posiada nasycony atom węgla, który przerywa sprzężenie wokół pierścienia.
Kation tropyliowy jest związkiem aromatycznym.
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!