Zadanie 4, arkusz maj 2024
Energia sieciowa związków jonowych to ilość energii potrzebna do rozłożenia jednego mola krystalicznej substancji na jony leżące nieskończenie daleko od siebie. Jej wartość zależy od rozmiarów jonów i ich ładunków. Wraz ze wzrostem energii sieciowej rosną wartości temperatury topnienia substancji krystalicznych.
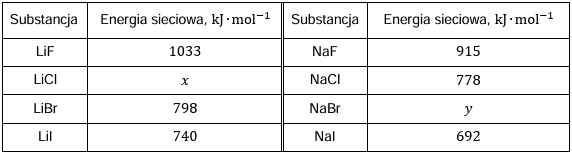
W tabeli przedstawiono wartości energii sieciowej halogenków wybranych litowców.
W poniższej tabeli przedstawiono wartości energii sieciowej dwóch związków oraz promieni tworzących je jonów.

Wyjaśnij, dlaczego – mimo zbliżonych rozmiarów jonów – energia sieciowa tlenku magnezu różni się znacznie od energii sieciowej fluorku litu.
…………………………………………………………………………………………………………… …………………………………………………………………………………………………………… …………………………………………………………………………………………………………… ……………………………………………………………………………………………………………
Przykładowe rozwiązania • Jony dwudodatnie i dwuujemne (Mg2+ i O2–) przyciągają się silniej niż jony jednododatnie i jednoujemne (Li+ i F–). • Im większe są wartości ładunków przyciągających się jonów, tym siła oddziaływania większa. • Im większe są wartości ładunków oddziałujących jonów, tym większa wartość energii sieciowej.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


