Reguła przekory
Reakcja syntezy amoniaku przebiega zgodnie z równaniem:
N2(g) + 3H2(g) ⇄ 2NH3(g)
W poniższej tabeli zestawiono wartości stałej równowagi reakcji syntezy amoniaku w różnych temperaturach.
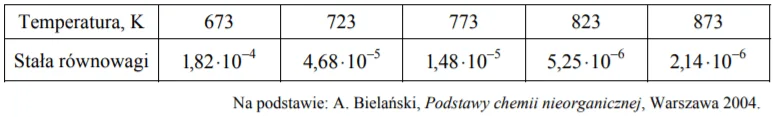
Przeanalizuj dane dotyczące syntezy amoniaku. Następnie uzupełnij zdania wyrażeniami spośród podanych w nawiasie (zmaleje, wzrośnie, nie zmieni się)
Jeżeli w układzie będącym w stanie równowagi nastąpi wzrost temperatury w warunkach izobarycznych (p = const), to wydajność reakcji syntezy amoniaku .............................................. , natomiast przy wzroście ciśnienia w warunkach izotermicznych (T = const) wydajność tego procesu .............................................. . Jeżeli zmaleje temperatura w układzie, to szybkość reakcji syntezy amoniaku .............................................. .
Jeżeli w układzie będącym w stanie równowagi nastąpi wzrost temperatury w warunkach izobarycznych (p = const), to wydajność reakcji syntezy amoniaku zmaleje, natomiast przy wzroście ciśnienia w warunkach izotermicznych (T = const) wydajność tego procesu wzrośnie. Jeżeli zmaleje temperatura w układzie, to szybkość reakcji syntezy amoniaku zmaleje.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


