Roztwory buforowe, bufor octanowy- równanie reakcji z mocną zasadą
Roztwory zawierające porównywalne liczby drobin kwasu Brønsteda i sprzężonej z nim zasady są nazywane roztworami buforowymi. Przykładem jest bufor octanowy. Kwasem Brønsteda są w nim cząsteczki CH3COOH, a zasadą – jony CH3COO– pochodzące z całkowicie zdysocjowanej soli, np. octanu sodu. Wprowadzenie do roztworu buforowego mocnego kwasu skutkuje zmniejszeniem stężenia zasady i wzrostem stężenia sprzężonego z nią kwasu. Dodatek mocnej zasady prowadzi do zmniejszenia stężenia kwasu i wzrostu stężenia sprzężonej zasady. Wartość pH buforu praktycznie nie zależy od jego stężenia i nieznacznie się zmienia podczas dodawania niewielkich ilości mocnych kwasów lub mocnych zasad.
a) Napisz w formie jonowej skróconej równanie reakcji zachodzącej podczas dodawania mocnej zasady (OH−) do buforu octanowego oraz uzupełnij zdanie – wybierz i podkreśl jedną odpowiedź spośród podanych w nawiasie.
Równanie reakcji z mocną zasadą:
......................................................................................................................................................
Po wprowadzeniu mocnego kwasu do buforu octanowego stężenie jonów octanowych (wzrośnie / zmaleje / nie ulegnie zmianie).
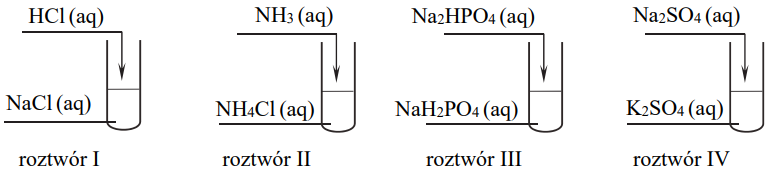
b) Przeprowadzono doświadczenie, w którym zmieszano jednakowe objętości wodnych roztworów różnych substancji. Wszystkie roztwory miały jednakowe stężenie molowe.
Mieszaniny przygotowano zgodnie z poniższym schematem.
Które z przygotowanych roztworów są buforami? Napisz ich numery.
a) Równanie reakcji z mocną zasadą:
CH3COOH + OH− ⇄ CH3COO−+ H2O
Po wprowadzeniu mocnego kwasu do buforu octanowego stężenie jonów octanowych (wzrośnie / zmaleje / nie ulegnie zmianie).
b) II, III
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.