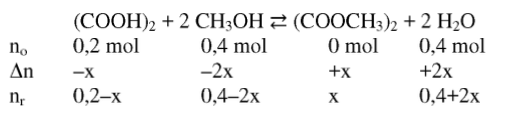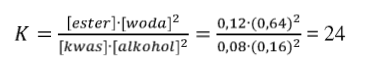Stała równowagi reakcji estryfikacji
Reakcja estryfikacji kwasu etanodiowego (szczawiowego) metanolem jest procesem równowagowym, biegnącym w obecności katalizatora kwasowego. W reakcji tej otrzymywano diester tego kwasu, zgodnie z równaniem:
(COOH)2 + 2CH3OH ⇄ (COOCH3)2 + 2 H2O
Do kolby zawierającej 12,80 g bezwodnego metanolu wprowadzono 25,20 g dihydratu kwasu etanodiowego (szczawiowego) oraz katalizator kwasowy. Homogeniczną mieszaninę ogrzewano w temperaturze, w której wydajność reakcji wynosiła 0,60.
Oblicz wartość stałej równowagi reakcji. Wynik podaj z dokładnością do jedności.
| Obliczenia:
Odpowiedź: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
M{CH3OH} = 32 g · mol-1
M{COOH)2 · 2H2O} = 126 g · mol-1
100% – 0,2 mol estru
60% – x mol estru
x = 0,12 mol estru
nr(kwas) = 0,08 mol nr(alkohol) = 0,16 mol
nr(ester) = 0,12 mol nr(woda) = 0,64 mol
nr jest proporcjonalne do stężeń molowych, gdyż objętość mieszaniny nie ulegnie zmianie.
Stała równowagi procesu estryfikacji wynosi 24.
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!