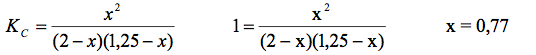Liczba moli estru – stężeniowa stała równowagi
Odwracalną reakcję estryfikacji kwasu etanowego z etanolem ilustruje równanie:
CH3COOH + CH3CH2OH ⇄ CH3COOCH2CH3 + H2O
W naczyniu o objętości 1 dm3 zmieszano 1,25 mola kwasu etanowego, 2,00 mole alkoholu etylowego oraz niewielką ilość stężonego H2SO4 i ogrzewano do ustalenia stanu równowagi. Oblicz, z dokładnością do dwóch miejsc po przecinku, liczbę moli estru w mieszaninie poreakcyjnej, jeżeli stężeniowa stała równowagi (Kc) tej reakcji w opisanych warunkach wynosi 1,00.
| Obliczenia:
Odpowiedź: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!