Jak zmienia się promień atomowy i skąd błędy na maturze?
Dzień dobry, dzień dobry! W tym artykule przyjrzymy się jak zmienia się promień atomowy. Jednym z najczęstszych błędów na maturze z tego tematu jest błędna analiza zmiany promienia atomowego w okresie. No bo z grupą to raczej każdy z Was sobie bez większego problemu radzi. No dobrze, ale zanim przejdziemy do szczegółów, zacznijmy od podstaw!
Spis treści
Czym jest promień atomowy?
Promień atomowy to odległość od jądra do ostatniej powłoki obsadzonej przez elektrony (lub elektron). Logiczne więc wydaje się to, że im więcej powłok elektronowych posiada atom, tym większy jest jego promień atomowy. Liczbę powłok elektronowych możemy określić odczytując numer okresu, w którym znajduje się dany atom pierwiastka.
Zauważ, że liczba atomowa rośnie wraz ze wzrostem liczby powłok w atomie. Nic w tym dziwnego, ponieważ liczba atomowa informuje nas o tym, ile elektronów posiada dany pierwiastek. Im jest ich więcej, tym więcej powłok potrzeba, aby mogły się one pomieścić w atomie.

Zatem możemy śmiało wyciągnąć wniosek, że promień atomowy rośnie wraz ze wzrostem liczby atomowej w grupie.
Czyli np. promień atomowy potasu będzie większy od promienia atomowego sodu. Dlaczego? Potas leży w 4-tym okresie, więc posiada 4 powłoki elektronowe. Natomiast sód leży w 3-cim okresie, zatem posiada 3 powłoki elektronowe. Im więcej powłok, tym większy promień atomowy.
Jak promień atomowy zmienia się w okresie?
Mnóstwo osób w takiej sytuacji idzie takim tropem: skoro liczba powłok jest taka sama, to promień atomowy będzie zależeć od liczby elektronów. No bo im jest ich więcej, tym więcej miejsca potrzebują i coraz bardziej “rozpychają się” na powłoce.
Czy takie rozumowanie prowadzi do prawidłowych wniosków?
Elektrony są turbo małe w odniesieniu do przestrzeni w jakiej krążą wokół jądra atomowego. Wyobraź sobie stadion olimpijski. Tak, ten olbrzymi moloch, który może pomieścić tysiące widzów na trybunach. No więc teraz na samym środku tego stadionu umieszczamy monetę o nominale 5 zł. Gdyby nasz atom był wielkości stadionu, to wielkość tej monety odpowiadałaby wielkości jądra atomowego.

Co z elektronami?
Są sporo mniejsze od jądra atomowego, więc bez najmniejszego problemu mieszczą się na powłokach bez konieczności “rozpychania się” na nich. Mają więcej miejsca, niż potrzebują.
No dobrze, ale co w takim razie wpływa na wielkość promienia atomowego jeśli porównujemy atomy pierwiastków o tej samej liczbie powłok elektronowych?
Odpowiedź: liczba protonów, które siedzą sobie w jądrze atomowym. Dlaczego?
Chodzi o to, że im większy ładunek ma jądro atomowe, tym silniej przyciąga krążące wokół niego elektrony. Oczywiście jądro atomowe ma zawsze ładunek dodatni, ponieważ mogą się w nim znajdować tylko protony (+) i neutrony (0). Możesz sobie wyobrazić, że w jądrze atomowym jest magnes o biegunie dodatnim. Im jest on większy, tym silniej przyciąga ładunki ujemne. Właśnie na takiej zasadzie działa to w atomach! Im więcej protonów w jądrze, tym silniej są przyciągane elektrony, a tym samym promień atomowy jest coraz mniejszy.

Jednak pamiętaj, że dotyczy to sytuacji, gdy porównujemy promienie atomowe pierwiastków posiadających tyle samo powłok elektronowych! Generalnie hierarchia ważności jest taka: liczba powłok elektronowych ma większy wpływ na promień atomowy, niż liczba protonów w jądrze atomowym.
Więc jeśli porównujemy promienie atomowe pierwiastków z tego samego okresu, to bierzemy pod uwagę liczbę protonów. Natomiast jeśli porównujemy promienie atomowe pierwiastków z różnych okresów, to bierzemy pod uwagę liczbę powłok elektronowych.
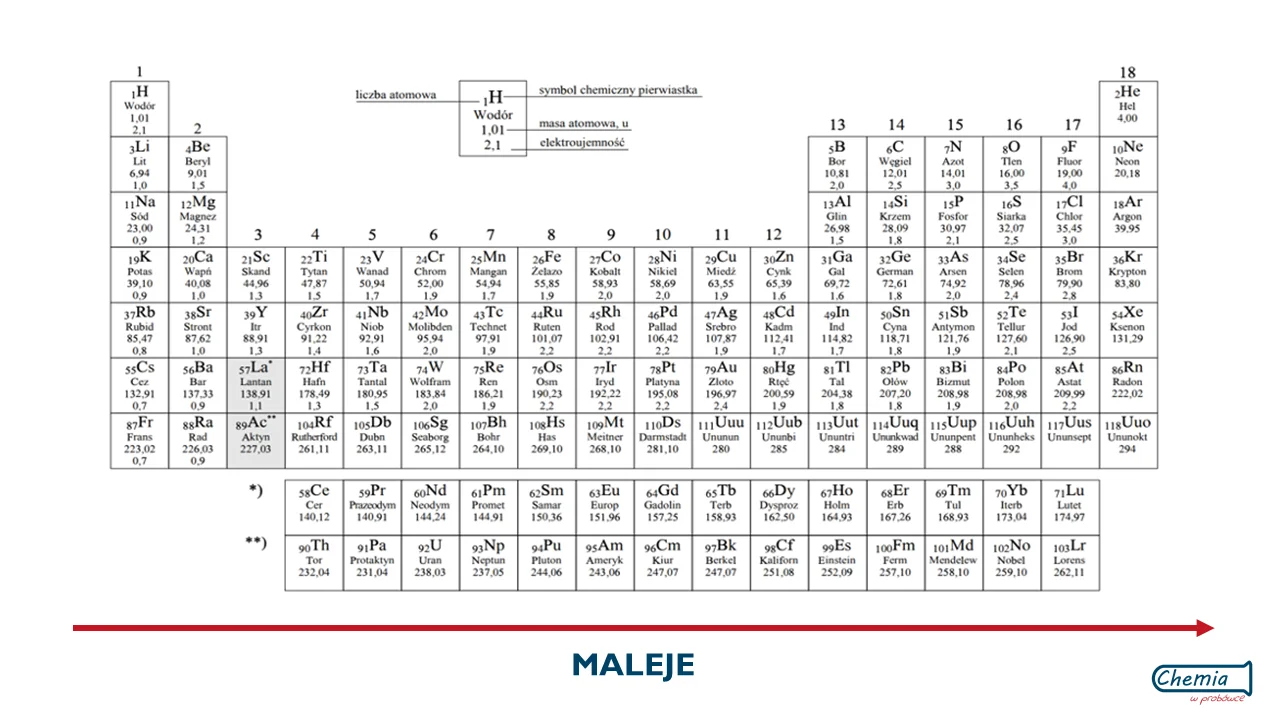
Podsumowując, w okresie liczba protonów w atomach rośnie w prawo czyli wraz ze wzrostem liczby atomowej. W końcu liczba atomowa określa liczbę protonów w jądrze atomowym danego pierwiastka. W związku z tym promień atomowy w okresie maleje wraz ze wzrostem liczby atomowej, czyli w prawo.
Podsumowanie
- W grupie promień atomowy rośnie wraz ze wzrostem liczby atomowej (w dół).
- Uzasadnienie: im więcej powłok elektronowych posiada dany pierwiastek, tym większy jest jego promień atomowy.
- W okresie promień atomowy maleje wraz ze wzrostem liczby atomowej (w prawo).
- Uzasadnienie: im większy ładunek ma jądro atomowe przy tej samej liczbie powłok elektronowych, tym silniej przyciąga elektrony.
No dobra, ale na maturze liczy się czas, więc warto też graficznie zapamiętać przyswojone informacje.
I dlatego przygotowałam dla Was mnemotechnikę, w dodatku świąteczną! 🙂 Przewrócona choinka powinna załatwić sprawę zapamiętania jak zmienia się promień atomowy w okresie.

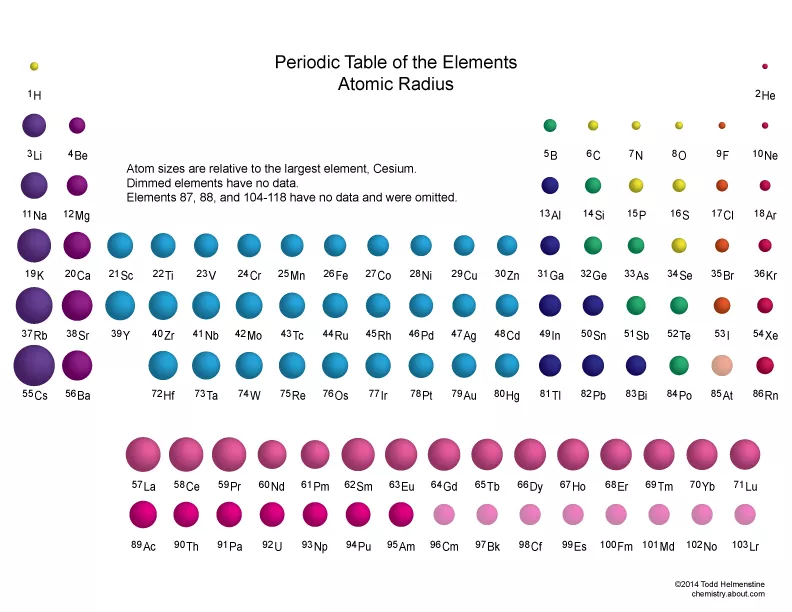
Na koniec jako ciekawostkę pokażę Wam jak dokładne zmiany promienia atomowego. Jak widać na poniższym zdjęciu, są odstępstwa od reguły, ale na maturze nikt ich od Was nie będzie wymagał.
www.thoughtco.com
Lekcje na temat promienia atomowego i zależności w układzie okresowym znajdziesz w moim maturalnym kursie chemii online. Poza wytłumaczeniem teorii znajdziesz w nich także sporo zadań wraz z rozwiązaniami, dzięki którym od razu sprawdzisz swoją wiedzę w praktyce!






