Wytrącanie osadu – kwas krzemowy
Przeprowadzono doświadczenie, w którym badano działanie pewnego odczynnika na dwa wodne roztwory soli. W probówce I znajdował się roztwór siarczanu(IV) sodu, a w probówce II – roztwór krzemianu(IV) sodu. Po dodaniu odczynnika zaobserwowano, że:
- w każdej probówce zaszła reakcja chemiczna
- przebieg doświadczenia był różny dla obu probówek
- tylko w jednej z probówek wytrącił się osad
a) Uzupełnij schemat doświadczenia. Wybierz i zaznacz w podanym zestawie wzór jednego odczynnika, którego zastosowanie spowodowało efekty opisane w informacji.
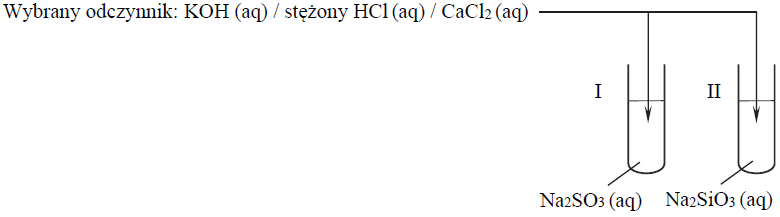
b) Napisz, co zaobserwowano w probówce, w której nie wytrącił się osad podczas opisanego doświadczenia.
...........................................................................................................................
...........................................................................................................................
c) Napisz w formie jonowej skróconej równania reakcji, które przebiegły w probówkach I i II i były przyczyną obserwowanych zmian.
Równanie reakcji przebiegającej w probówce I:
.....................................................................................................................................................
Równanie reakcji przebiegającej w probówce II:
.....................................................................................................................................................
a)
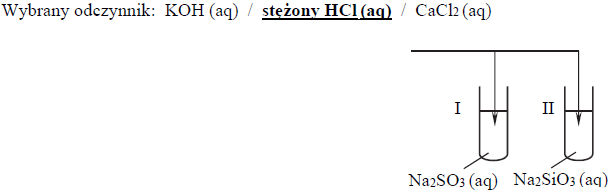
b)Wydziela się bezbarwny gaz o ostrym, charakterystycznym zapachu.
lub
Wyczuwalny jest charakterystyczny zapach.
c)
SO32- + 2H+ → SO2 + H2O
lub
SO32- + 2H3O+ → SO2 + 3H2O
Probówka II :
SiO32- + 2H+ → H2SiO3
lub
SiO32- + 2H3O+ → H2SiO3 + 2H2O
H2SiO3 można zapisać również jako SiO2 ∙ H2O lub SiO2 + H2O
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


