Tlenki mieszane – czym są i jak je zapisywać?
Ten artykuł pomoże Wam zrozumieć czym są tlenki mieszane i jak w odpowiedni sposób rozwiązać reakcje redoks z użyciem tych związków chemicznych na maturze. Zanim jednak przejdziemy do sedna, przypomnijmy sobie czym są tlenki.
Tlenki
Tlenki to nieorganiczne związki chemiczne, które zbudowane są z przynajmniej jednego atomu tlenu i innego pierwiastka chemicznego. Powstają poprzez reakcję pierwiastków z tlenem, utlenianie tlenków, w których pierwiastek jest na niższym stopniu utlenienia, a także przez rozkład związków niektórych związków zawierających tlen np. węglanów, wodorowęglanów itd.. Przykładami najbardziej znanych tlenków jest woda (H2O), krzemionka (SiO2), czy dwutlenek węgla (CO2). Tlenki możemy podzielić na grupy pod względem właściwości chemicznych, czyli pod względem tego z jakimi substancjami reagują i co w wyniku tej reakcji powstaje.
Możemy wyróżnić tlenki:
- zasadowe, czyli tlenki metali pierwszej i drugiej grupy (bez berylu) oraz niektóre tlenki pierwiastków z bloku d
- kwasowe, czyli wiele tlenków niemetali,
- amfoteryczne zawierające najczęściej pierwiastek z bloku d, na pośrednim stopniu utlenienia,
- obojętne, czyli głównie tlenki niemetali na +II stopniu utlenienia.
Więcej informacji na temat tlenków, nadtlenków i tlenu znajdziesz w moim kursie z chemii online i poświęconej temu tematowi lekcji. Zapraszam! A teraz przejdę do bohaterów dzisiejszego artykułu – tlenków mieszanych.
Tlenki mieszane
Tlenki mieszane to takie tlenki, w których część atomów metalu ma inną wartościowość niż pozostałe. Czyli na przykład w tlenku żelaza (II,III), Fe3O4, atomy żelaza mają różne wartościowości. Dwa atomy żelaza są trójwartościowe, a jeden atom jest dwuwartościowy. Analogicznie jest ze stopniami utlenienia w tych związkach (pamiętajcie, że wartościowość i stopień utlenienia pierwiastka to nie to samo!). W przypadku tlenków mieszanych bardzo ważne jest aby nie mylić ich z mieszaninami tlenków! Poniżej przedstawiam Wam listę najważniejszych tlenków mieszanych.

Przykłady tlenków mieszanych:
- Pb3O4 , inaczej 2PbO ∙ PbO2 – tetratlenek triołowiu (minia ołowiana), o którym więcej informacji znajdziesz w artykule o Upadku Imperium Rzymskiego
- Mn3O4, inaczej MnO ∙ Mn2O3. – tetratlenek trimanganu
- U3O8 , inaczej U2O5 ∙ UO3 – oktatlenek triuranu
- Fe3O4, inaczej FeO ∙ Fe2O3 – tetratlenek triżelaza
Jak poprawnie zapisywać wzory tlenków mieszanych?
Jest to jedna substancja, ale może być zapisana na dwa sposoby, tak jak widzieliście powyżej. Szczególnie ważne jest to, aby nie popełnić błędu w przypadku zapisu dwuczłonowego.
Zawsze piszemy znak mnożenia “∙” pomiędzy członami, a nie “+” jak byłoby to w przypadku mieszaniny tlenków. Tlenek mieszany to jedna substancja a nie mieszanina dwóch różnych tlenków! Zapis ze znakiem “+” sugeruje, że są to dwie różne substancje zmieszane ze sobą, a tlenek mieszany nie jest mieszaniną!
Na przykład, dla minii ołowianej tylko zapisy Pb3O4 i 2PbO ∙ PbO2 są poprawne.

Taki sposób zapisu również jest bardzo ważny przy równaniach reakcji redoks. Wtedy koniecznie, nawet w reakcjach połówkowych, musicie użyć formy ze znakiem mnożenia pomiędzy członami, ale najlepiej zapisać cały wzór tlenku. Poniżej przykład równania reakcji redoks z tlenkiem mieszanym.
Równanie reakcji redoks z tlenkiem mieszanym – Fe3O4
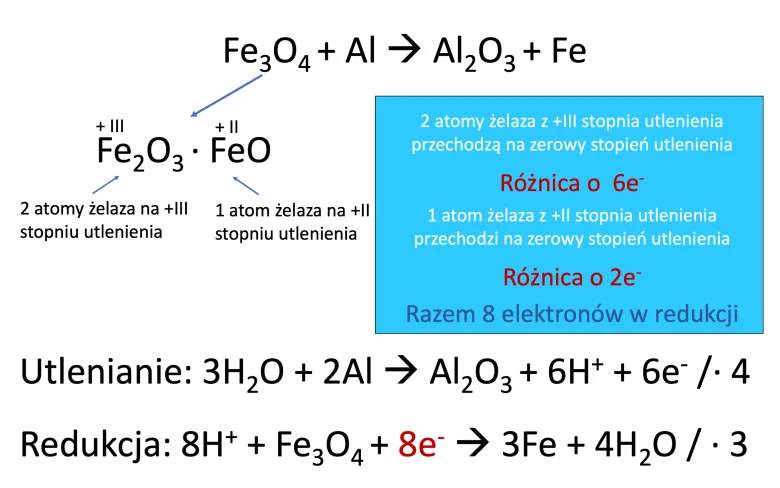
Po zapisaniu równań połówkowych i przemnożeniu ich przez odpowiednie liczby, możemy ustalić współczynniki stechiometryczne w równaniu reakcji i zapisać ją w formie ostatecznej:
3Fe3O4 + 8Al → 4Al2O3 + 9Fe
Podsumowując – jeśli na maturze dostaniecie zadanie, gdzie wystąpi tlenek mieszany zawsze pamiętajcie, aby w dwuczłonowej formie zapisu zawsze pisać znak “∙” pomiędzy członami a nie “+”. Jednocześnie robiąc bilans elektronowo-jonowy w brudnopisie “rozbijcie” sobie ten tlenek na dwa człony. Następnie określcie stopnie utlenienia i policzcie liczbę elektronów, która będzie potrzebna do zapisu równań połówkowych. Wtedy możecie śmiało działać dalej!
Jeśli tlenki, reakcje redoks lub stopnie utlenienia sprawiają Wam problem, zapraszam do mojego kursu chemii online. Z pewnością rozwieje on wiele Waszych wątpliwości i pomoże solidnie przygotować się do matury. Trzymam kciuki za Waszą naukę.
Powodzenia!




