Redoks i miareczkowanie kwasu askorbinowego
Zawartość kwasu askorbinowego w próbce wyznacza się na podstawie stechiometrii jego reakcji z jodem. Do roztworu zawierającego nieznaną ilość kwasu askorbinowego i niewielką ilość skrobi dodaje się kroplami roztwór jodu w roztworze jodku potasu. Stężenie roztworu jodu musi być dokładnie znane, a jego objętość – mierzona. Mówimy, że roztwór kwasu askorbinowego miareczkuje się roztworem jodu. Dopóki kwas askorbinowy jest obecny w roztworze, zachodzi reakcja, którą można w uproszczeniu opisać równaniem:
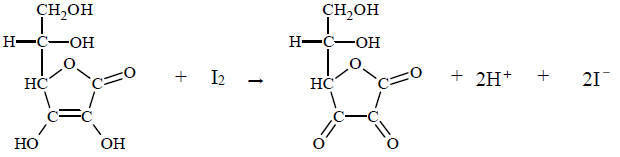
Gdy cały kwas askorbinowy przereaguje, jod dostarczony w nadmiarowej kropli poskutkuje zabarwieniem skrobi. W tym momencie kończy się miareczkowanie, co oznacza, że osiągnięto punkt końcowy i należy odczytać objętość zużytego roztworu jodu. Gdy zna się jego stężenie, można obliczyć, ile kwasu askorbinowego zawierała próbka.
Podaj, jaką funkcję (utleniacza czy reduktora) pełni jod w reakcji z kwasem askorbinowym. Napisz, na jaki kolor zabarwi się mieszanina reakcyjna w punkcie końcowym miareczkowania.
Jod w reakcji z kwasem pełni funkcję .........................................................................................
Pod wpływem jodu skrobia zabarwi się na .................................................................................
Jod w reakcji z kwasem pełni funkcję utleniacza.
Pod wpływem jodu skrobia zabarwi się na ciemnoniebiesko lub niebiesko lub granatowo lub czarno.
Uwaga: Barwa: fioletowa lub ciemnofioletowa, lub fioletowogranatowa, lub inna wskazująca na fioletowy odcień jest błędna.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


