Równowaga chemiczna – wykres zawartości dwutlenku węgla w % objętościowych względem zmian temperatury
W wysokiej temperaturze węgiel reaguje z tlenkiem węgla(IV) i ustala się równowaga chemiczna:
CO2 (g) + C (s) ⇄ 2CO (g)
Objętościową zawartość procentową CO i CO2 w gazie pozostającym w równowadze z węglem w zależności od temperatury (pod ciśnieniem atmosferycznym 1013 hPa) przedstawiono na poniższym wykresie.
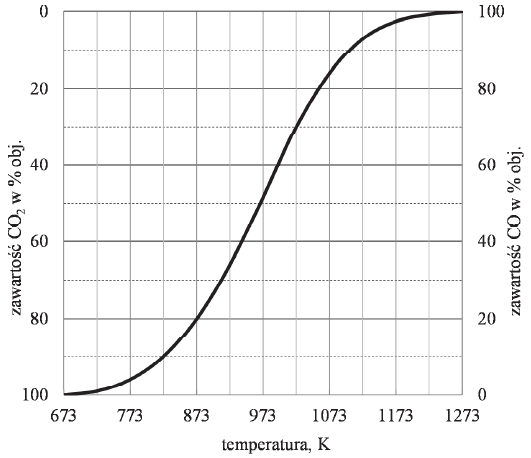
Oblicz wyrażoną w procentach masowych zawartość tlenu, wchodzącego w skład CO2 i CO, w pozostającej w równowadze mieszaninie tych związków z węglem w temperaturze 873 K i pod ciśnieniem 1013 hPa. Możesz przyjąć, że sumaryczna liczba moli gazowego substratu i gazowego produktu reakcji jest równa 1. W opisanych warunkach 1 mol gazu zajmuje objętość 71,6 dm3.
Obliczenia :
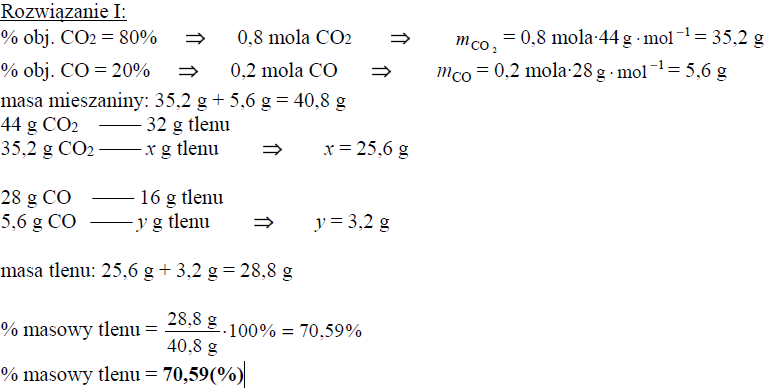
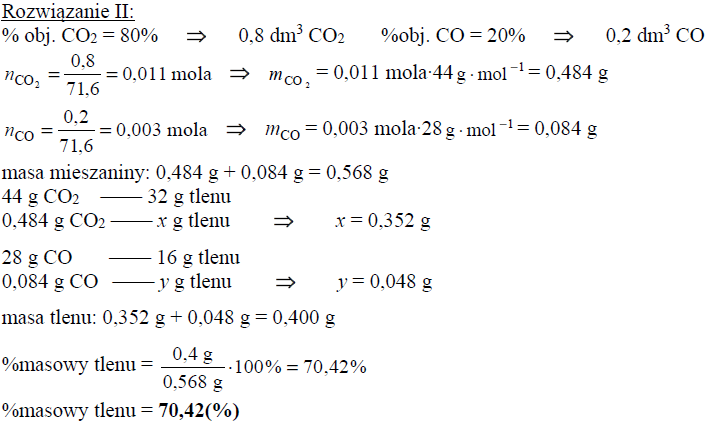
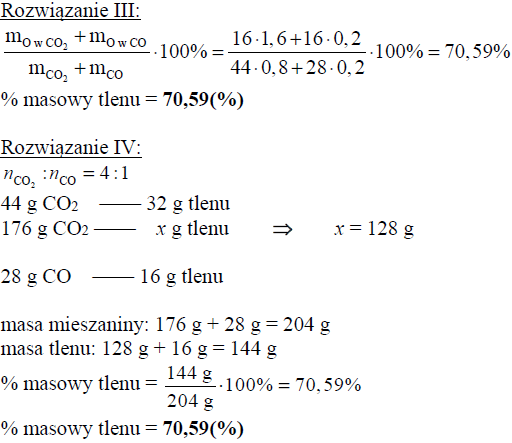
Uwaga! Należy zwrócić uwagę na zależność wyniku liczbowego od przyjętych zaokrągleń.
Uwaga! Za rozwiązanie odnoszące się do warunków normalnych (Vmol = 22,4 dm3·mol–1 ), należy przyznać 0 pkt.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


