Obliczanie stałej dysocjacji zasadowej hydrolizy jonu węglanowego
Węglany w roztworach wodnych ulegają hydrolizie anionowej, która polega na dysocjacji zasadowej anionu, zgodnie z równaniem:
![]()
Drugi etap hydrolizy polegający na reakcji jonu HCO3− z wodą zachodzi w tak małym stopniu, że nie ma wpływu na pH roztworu.
W temperaturze 25 °C wodny roztwór węglanu potasu o stężeniu 0,51 mol ⋅ dm−3 ma pH równe 12,0.
Oblicz stałą dysocjacji zasadowej (stałą równowagi reakcji hydrolizy) anionu węglanowego. Uwzględnij fakt, że w wyrażeniu na stałą dysocjacji zasadowej anionu węglanowego pomija się stężenie wody.

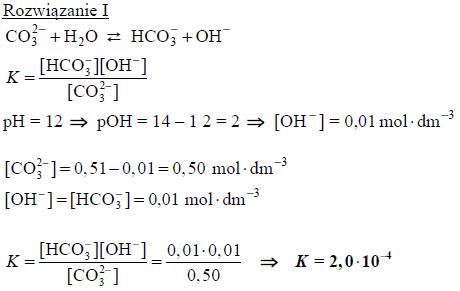
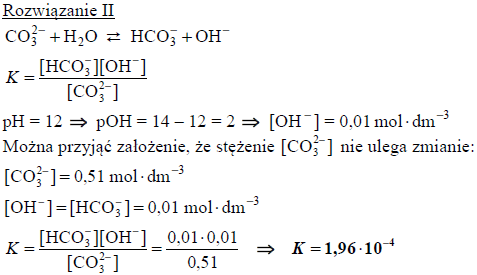
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


