Miareczkowanie fenolu
Oznaczanie zawartości fenolu w ściekach przemysłowych możne przebiegać w kilku etapach opisanych poniżej.
Etap I: Otrzymywanie bromu.
Etap II: Bromowanie fenolu.
Etap III: Wydzielanie jodu.
Etap IV: Miareczkowanie jodu.
a)Podczas etapu I (oznaczania zawartości fenolu) zachodzi reakcja jonów bromkowych z jonami bromianowymi (V) - BrO3- – w roztworze o odczynie kwasowym. Produktami tej przemiany są brom i woda.
Napisz w formie jonowej, z uwzględnieniem liczby oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy), równanie reakcji redukcji i równanie reakcji utleniania zachodzących podczas opisanego procesu (etapu I). Uwzględnij środowisko reakcji.
Równanie reakcji redukcji:
.......................................................................................................................................................
Równanie reakcji utleniania:
.......................................................................................................................................................
b)Gdy do zakwaszonego roztworu fenolu zawierającego nadmiar jonów bromkowych wprowadzi się bromian(V) potasu w nadmiarze w stosunku do fenolu, to wytworzony brom (w ilości równoważnej do bromianu(V) potasu) reaguje z fenolem zgodnie z równaniem (etap II):

Następnie do powstałej mieszaniny dodaje się jodek potasu. Brom, który nie został zużyty
w reakcji bromowania, powoduje wydzielenie równoważnej ilości jodu (etap III):
2I −+ Br2 →2Br −+ I2
Podczas kolejnego etapu (etapu IV) jod miareczkuje się wodnym roztworem tiosiarczanu
sodu (Na2S2O3), co można zilustrować równaniem:
![]()
Oblicz stężenie molowe fenolu w próbce ścieków o objętości 100,0 cm3, jeżeli wiadomo, że w etapie I oznaczania zawartości fenolu powstało 0,256 grama bromu oraz że podczas etapu IV oznaczania tego związku na zmiareczkowanie jodu zużyto 14,00 cm3 roztworu tiosiarczanu sodu o stężeniu 0,100 mol · dm–3.

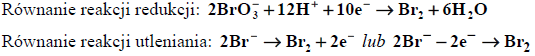

Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


