Kwasy karboksylowe – redoks
Przeprowadzono doświadczenie, którego przebieg przedstawiono na poniższym schemacie.
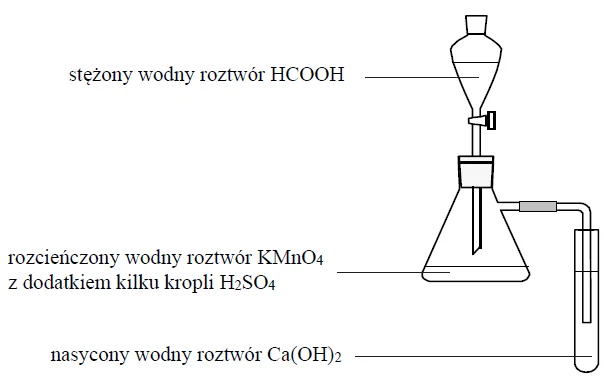
Po delikatnym ogrzaniu kolby z mieszaniną reakcyjną zaobserwowano odbarwianie roztworu w kolbie oraz powstanie białego osadu w probówce.
Uzupełnij poniższy zapis, tak aby przedstawiał on w formie jonowej skróconej równanie reakcji, która zaszła w kolbie podczas przeprowadzonego doświadczenia. Oceń, czy gdyby do opisanego doświadczenia użyto kwasu etanowego zamiast kwasu metanowego, również zaobserwowano by odbarwienie roztworu w kolbie oraz powstanie osadu w probówce. Uzasadnij swoje stanowisko.
Równanie reakcji:
.....HCOOH + ......MnO4- + ......H+ → ......................................................................................
Ocena wraz z uzasadnieniem:
..................................................................................................................................................................................................................................................................................................................................................................................................................................................
Uwaga: zapisy pomocnicze (nad miejscem na odpowiedź) nie podlegają ocenie z wyjątkiem sytuacji, gdy zdający nie zapisze równania reakcji w miejscu na to przeznaczonym.
5HCOOH + 2MnO4– + 6H+ → 2Mn2+ + 5CO2 + 8H2O
![]()
Ocena wraz z uzasadnieniem:
• Nie, ponieważ kwas octowy nie ma właściwości redukujących.
• Użycie kwasu etanowego (octowego) zamiast kwasu metanowego (mrówkowego) nie spowoduje opisanego przebiegu reakcji, ponieważ (w opisanych warunkach) kwas octowy nie ulega utlenieniu.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


