Nigdy więcej nie pomylisz już wartościowości ze stopniem utlenienia!
Wartościowość to jedno z pierwszych pojęć, które można usłyszeć na chemii w gimnazjum. Z czasem, przy reakcjach redoks pojawia się też zagadnienie kolejne – stopień utlenienia . Możliwe również, że pierwsze co przychodzi Wam na myśl słysząc o stopniu utlenienia lub wartościowości to cyfry rzymskie nad pierwiastkiem. Jeśli tak myślicie – macie rację. Jednak nie myślcie, że te dwa pojęcia oznaczają to samo. To nieprawda – wartościowość i stopień utlenienia to dwa odrębne zagadnienia. Chciałabym zaznaczyć, że pomimo podobnej formy graficznej to dwa różne pojęcia, które dają nam inne informacje. Więc czym różni się wartościowość i stopień utlenienia?
Czym jest wartościowość, a czym stopień utlenienia?
Wartościowość
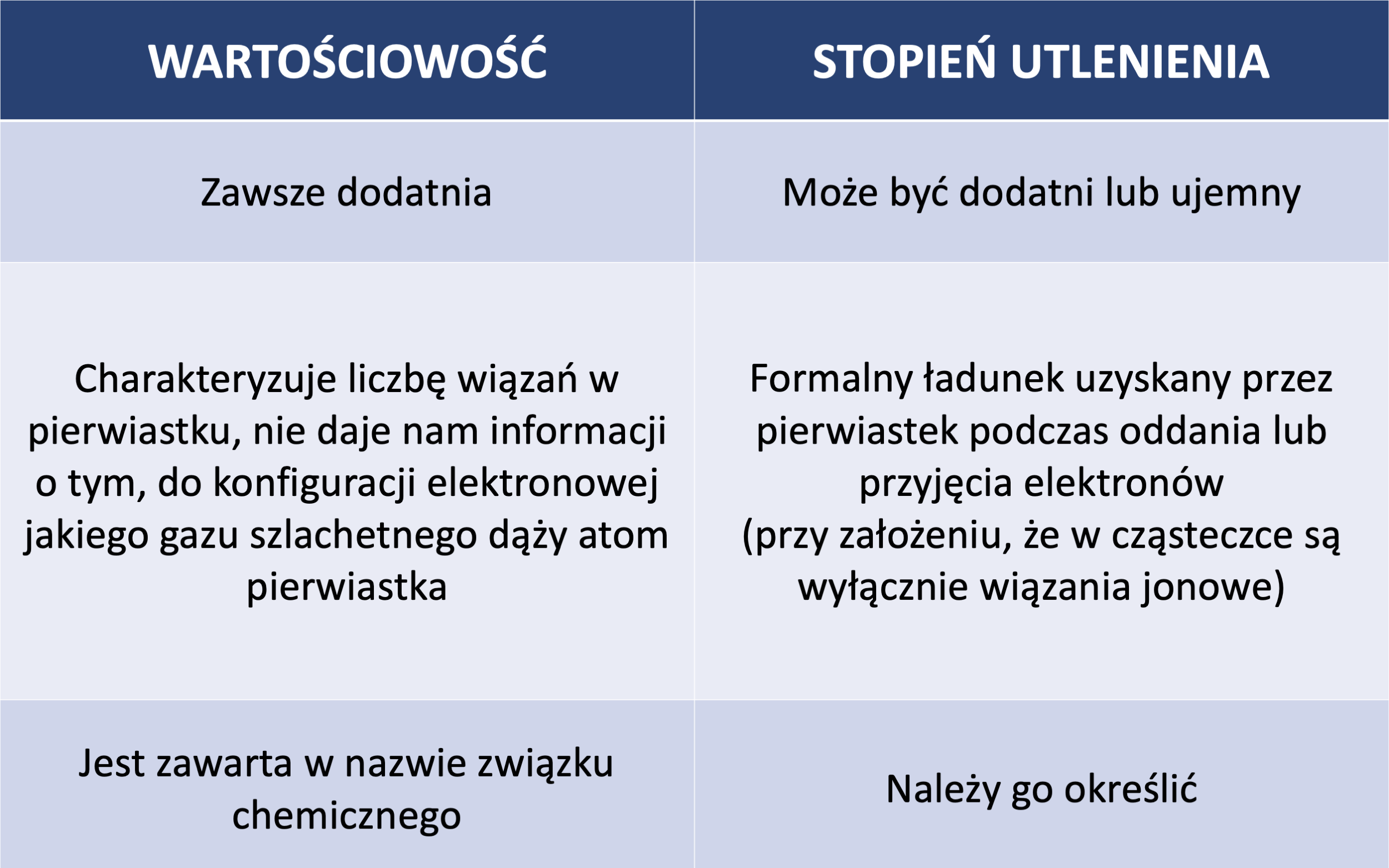
Jest to liczba wiązań utworzonych przez dany pierwiastek. Chodzi o te kreski pomiędzy atomami, które dokładniej tłumaczę w lekcji o wiązaniach chemicznych. Maksymalną wartościowość pierwiastka można odczytać z układu okresowego. O wartościowości informację dostajemy z numeru grupy głównej. Na przykład: wodór jest jednowartościowy, bo leży w pierwszej grupie.
Natomiast azot jest maksymalnie pięciowartościowy, bo leży w piętnastej grupie (odejmujemy dziesięć od piętnastki tak aby określić liczbę elektronów walencyjnych pierwiastka i mamy proste działanie matematyczne : 15-10=5, czyli maksymalną wartościowość pierwiastka). Szczególną uwagę należy zwrócić na słowo “maksymalnie”.
To, że azot może być MAKSYMALNIE pięciowartościowy oznacza, że może mieć też niższą wartościowość niż pięć. Na przykład w amoniaku, czy kwasie azotowym (III), azot jest trójwartościowy.

Stopień utlenienia
Stopień utlenienia to ładunek, jaki pierwiastek lub grupa pierwiastków uzyskała podczas przyjmowania, bądź oddawania elektronów. Należy jednak zaznaczyć, że jest to ładunek formalny (pewnego rodzaju narzędzie), ponieważ zakładamy, że pomiędzy atomami w analizowanej cząsteczce, występują wyłącznie wiązania jonowe. To nie jest w pełni prawdą, ponieważ w wielu przypadkach między atomami jest obecne wiązanie kowalencyjne spolaryzowane i niespolaryzowane.
Stopień utlenienia to pojęcie, które jest narzędziem ułatwiającym pracę przy bilansie ładunku reakcji. W tym wypadku założenie, że wszystkie wiązania w cząsteczce mają charakter jonowy, upraszcza sprawę. I działa jak należy!
Zasad pomagających określić stopień utlenienia jest kilka. Atomy w stanie wolnym mają zawsze stopień utlenienia równy zero. Suma stopni utlenienia wszystkich atomów wchodzących w skład cząsteczki również jest równa zero. Jednak suma stopni utlenienia wszystkich atomów wchodzących w skład jonu, równa jest ładunkowi jonu.
Atomy, które tworzą związek chemiczny, aby zapewnić sobie stabilność, dążą do uzyskania konfiguracji elektronowej najbliższego gazu szlachetnego, tj. dubletu (2 elektrony walencyjne) lub oktetu elektronowego (8 elektronów walencyjnych). Powstawanie jonów to jeden ze sposobów osiągnięcia trwałej konfiguracji elektronowej przez atomy. Polega na oddawaniu lub przyjmowaniu elektronów. Stąd wiemy, jak określić stopień utlenienia pierwiastka.
Podczas utleniania atomy oddają elektrony, a ich stopień utlenienia staje się wyższy, natomiast podczas redukcji atomy przyjmują elektrony, a ich stopień utlenienia staje się niższy.
Jak dokładnie ustalić stopień utlenienia pierwiastka? To zagadnienie dokładnie tłumaczę w probówce o stopniu utlenienia.
Zatem wartościowość, czy stopień utlenienia?
Pojęcie wartościowości jest dość mocno nieprecyzyjne, przez co również rzadko używane. Dlaczego? Weźmy wspomniany wcześniej azot. Wartościowość w amoniaku wynosi trzy i w kwasie azotowym (III) również wynosi III. Nie daje nam to jednak informacji o tym jakie otoczenie ma azot w danym związku chemicznym. Natomiast jeśli określimy stopień utlenienia w tych związkach, okazuje się, że w przypadku amoniaku wynosi on -III, a w kwasie azotowym (III) +III. To znaczy, że w amoniaku azot ma ujemny stopień utlenienia, ponieważ przyjął trzy elektrony, a w kwasie ma dodatni stopień utlenienia, co oznacza, że oddał trzy elektrony. W tej sytuacji azot ma w tych związkach taką samą wartościowość, ale inny stopień utlenienia. I to jest informacja, która będzie nam potrzebna w tworzeniu bilansu elektronowego i przy ustalaniu współczynników w równaniach reakcji redoks. Możemy także dodać, że wartościowość jest elementem nazwy danego związku – tak jak we wspomnianym już kwasie azotowym (III).

Podsumowanie
Wartościowość i stopień utlenienia na pierwszy rzut oka to zagadnienia podobne. Jednak nie są tym samym i dają nam różne informacje o pierwiastku.
Pojęcie pierwsze charakteryzuje liczbę wiązań, jakie tworzy pierwiastek w danym związku chemicznym. Natomiast stopień utlenienia to ładunek formalny (umowny), który pierwiastek uzyskuje na skutek oddawania lub przyjmowania elektronów. Wartościowość ma zawsze wartość dodatnią (bo nie można mieć przecież ujemnej liczby wiązań!), a stopień utlenienia może być zarówno dodatni, jak i ujemny. Wartościowość nie dostarcza nam informacji o otoczeniu pierwiastka w danym związku chemicznym, dopiero stopień utlenienia to różnicuje. Stopień utlenienia jest także “narzędziem”, bez którego nie da się zrobić bilansu elektronowego.
Mam nadzieję, że już nigdy te dwa pojęcia nie będą Wam się mieszać i zrozumieliście jakie są najważniejsze różnice między nimi. Jeśli jesteście głodni większej dawki wiedzy, albo chcecie rozwiać chemiczne wątpliwości, zapraszam do korzystania z mojego kursu online Chemia w Probówce. Staram się tam przejrzyście tłumaczyć każde zagadnienie do egzaminu maturalnego w formie krótkich, łatwo przyswajalnych probówek. Podobno działa też na tych opornych – zapraszam! 🙂






