Stan podstawowy i wzbudzony. Dlaczego sole barwią płomień palnika?

Jak powstaje zorza polarna? Dlaczego różne sole ogrzewane w płomieniu palnika barwią ten płomień na różne kolory? I dlaczego fajerwerki mają różne barwy? Te pytania mają wspólną odpowiedź :-). Ale żeby ją dobrze zrozumieć musisz wiedzieć czym jest STAN PODSTAWOWY i STAN WZBUDZONY atomu.
Stan podstawowy
Stan podstawowy to stan, w którym elektrony w atomie są rozmieszczone tak, aby ten atom miał jak najmniejszą energię. Dlaczego? Wszystko w przyrodzie dąży do tego, żeby mieć jak najmniejszą energię. Tak jest najbezpieczniej, bo rachunki za prąd przychodzą wtedy najmniejsze. Żarcik! 🙂 Po prostu każdy atom próbuje tak rozmieścić swoje elektrony-bejbiki, aby były jak najbliżej mamusi-jądra atomowego. Właśnie dlatego najpierw obsadzane elektronami są orbitale atomowe o najmniejszej wartości energii. Kolejność obsadzania orbitali atomowych ilustruje poniższy schemat:
Jak widzisz różnice energii pomiędzy kolejnymi poziomami energetycznymi w miarę wzrostu numeru powłoki są coraz mniejsze. Gdy elektrony w atomie rozmieszczone są zgodnie z zasadą rozbudowy powłok elektronowych, to taki atom znajduje się w stanie podstawowym, czyli ma najmniejszą możliwą energię. Leży do góry brzuchem i nic nie musi robić.
Jeśli taki atom w stanie podstawowym dostanie dodatkową porcję energii, czyli na przykład zostanie mu dostarczona energia w postaci ciepła podczas ogrzewania, to może on przejść w stan wzbudzony. Elektrony w atomie posiadają wtedy większą energię, a co za tym idzie – układ jest mniej stabilny i to niesie poważne konsekwencje! Ale o tym opowiem za chwilę.
Najpierw przeanalizujmy co się dzieje w momencie gdy atom ze stanu podstawowego przechodzi w stan wzbudzony. Przeanalizujemy to na przykładzie atomu azotu. W stanie podstawowym jego konfiguracja elektronowa wygląda następująco:
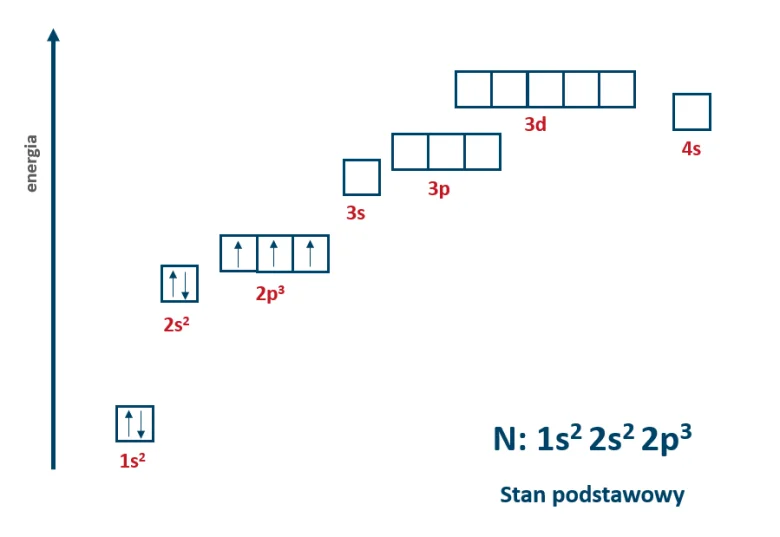
Azot w stanie podstawowym posiada 5 elektronów walencyjnych, w tym 3 niesparowane. Gdy zostanie mu dostarczona energia, jeden z elektronów sparowanych z poziomu 2s może wyruszyć w podróż i znaleźć się na najbliższym wolnym poziomie energetycznym. Najbliżej znajduje się poziom 3s i też tam ten elektron wyląduje. Atom azotu po wzbudzeniu ma nową konfigurację elektronową, a w jej zapisie przy atomie azotu dopisujemy gwiazdkę. W ten sposób zaznacza się konfigurację elektronową w stanie wzbudzonym.
Stan wzbudzony
Tak jak wcześniej wspominałam, stan wzbudzony jest stanem nietrwałym, ponieważ elektrony mają większą energię niż w stanie podstawowym. W związku z tym taki układ istnieje tylko przez chwile, a potem elektron “uciekinier” powraca na swój wyjściowy poziom. Pytanie, co dzieje się wtedy z energią, którą pobrał, aby pospacerować sobie po wyższych poziomach energetycznych?
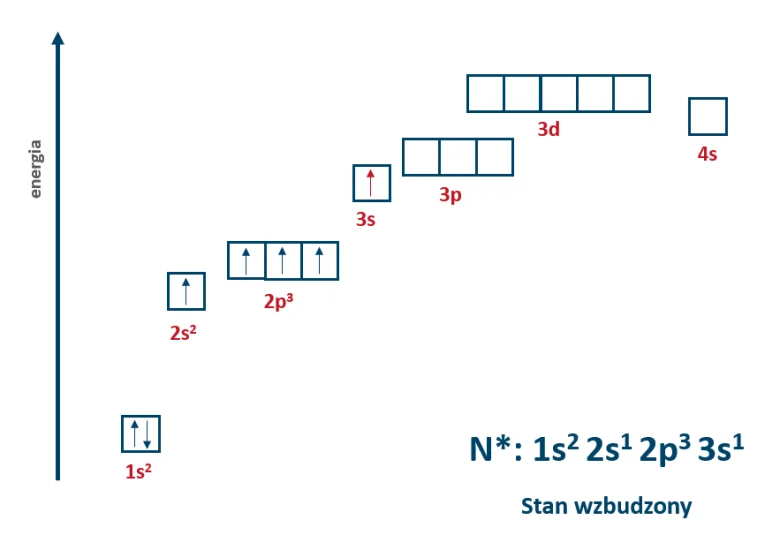
Przejściu elektronu z jednej powłoki lub podpowłoki na inną towarzyszy emisja lub absorpcja energii. Gdy elektron pochłania energię, czyli ją absorbuje to może przejść z poziomu niższego na wyższy. Jednak gdy elektron “uciekinier” powraca do poprzedniego poziomu, to energia, którą jest “napakowany” jest wypromieniowywana czyli emitowana. Chodzi o to, że aby mieszkać sobie w danym orbitalu, to trzeba do niego pasować pod względem energii. Zatem jeśli elektron ma zająć miejsce na swoim wyjściowym orbitalu, to musi pozbyć się energii, która została mu dostarczona. Co się dzieje z tą energią? Następuje jej emisja a my widzimy to w formie światła o określonej barwie.
Jak powstają kolory?

Światło widzialne to fale elektromagnetyczne o określonej długości. W zależności od tego jaką energię emituje dany atom podczas powrotu ze stanu wzbudzonego do stanu podstawowego, taką barwę będziemy dostrzegać. Jeśli fala elektromagnetyczna jaka dotrze do naszego oka będzie miała długość około 700 nm to zaobserwujemy barwę czerwoną, jeśli fala będzie miała długość około 400 nm będziemy widzieć barwę zieloną itd. Zgodnie ze schematem.
Ok, czym jest stan podstawowy a czym stan wzbudzony już wiesz. Teraz możemy przejść do ciekawszych rzeczy.
Jak powstaje zorza polarna?

Wiadomo, że powstaje ona na północnej części kuli ziemskiej gdzie jest dużo lodowców. Z tego powodu kiedyś uważano, że ten taniec światła na niebie jest wynikiem odbijania się światła od lodowców. Jednak przyczyna tego zjawiska jest zupełnie inna. Wiatr słoneczny czyli strumień naładowanych cząstek takich jak elektrony i protony uwięziony w polu magnetycznym Ziemi przenika do jonosfery czyli warstwy Ziemi zawierającej duże ilości plazmy.
Plazma to elektrycznie obojętna “chmura” zjonizowanej materii. Ta która “wypływa” ze Słońca jest nazywana właśnie wiatrem słonecznym. W jonosferze Ziemi cząstki z plazmy zderzają się z cząsteczkami azotu i tlenu przekazując im energię. No i teraz elektrony w azocie i tlenie wykorzystują sobie tą energię na wędrówkę na wyższe poziomy energetyczne. Jak już sobie pozwiedzają to oczywiście powracają do stanu podstawowego, co wiąże się z oddaniem pochłoniętej energii. Taniec światła na niebie czyli zorza polana jest tego efektem, bo tlen atomowy emituje światło o barwie biało-zielonej, a azot – czerwonej.
Dlaczego różne sole barwią płomień na różne barwy?
Przyczyna jest taka sama. Na skutek absorbcji energii elektrony w metalach mogą przeskakiwać na wyższe poziomy energetyczne, a później wracać na wyjściowe co wiąże się z emisją energii. Każdy metal ma inną konfigurację elektronową, a co za tym idzie – przejście ze stanu wzbudzonego do stanu podstawowego będzie wiązało się z emisją innej długości fali, a my będziemy widzieć inną barwę płomienia.
P.S. Źródłem energii jest płomień palnika, a fakt iż różne metale barwią go na różne kolory można wykorzystać w ich identyfikacji. Nazywamy to próbą płomieniową. Jakie barwy możemy uzyskać wprowadzając na metalowej łyżce do spalań próbkę soli? Jeśli jest to:
- sól wapnia Ca płomień zabarwi się na kolor ceglastoczerwony
- sól strontu Sr – kolor karminowy
- sól baru Ba – kolor zielony
- sól sodu Na – kolor żółty

Fajerwerki mają różne barwy, ponieważ są do nich dodawane właśnie sole różnych metali. Jak wiadomo, podczas wybuchu fajerwerków, dostarczana jest duża ilość energii cieplnej, a metale z soli przechodzą w stan wzbudzony. Następnie wracając do stanu podstawowego, emitują światło o różnej barwie.
Zagadka rozwiązana 🙂