Reguła przekory
W wyniku pewnej odwracalnej reakcji chemicznej z dwóch substratów powstaje jeden produkt. Przemiana przebiega w fazie gazowej, co oznacza, że oba substraty i produkt są gazami. Reakcję tę przeprowadzono w zamkniętym reaktorze przy użyciu stechiometrycznych ilości substratów w różnych temperaturach i pod różnym ciśnieniem. Na poniższym diagramie przedstawiono, jaki procent objętości mieszaniny poreakcyjnej w reaktorze stanowiła objętość produktu tej reakcji w zależności od warunków temperatury i ciśnienia, w jakich przebiegała.

a)
Na podstawie analizy diagramu określ, czy w czasie opisanej reakcji układ oddaje energię do otoczenia, czy przyjmuje ją od otoczenia. Odpowiedź uzasadnij.
b)
Na podstawie analizy diagramu określ, czy w równaniu stechiometrycznym opisanej reakcji łączna liczba moli substratów jest mniejsza, czy – większa od liczby moli produktu, czy też – równa liczbie moli produktu. Odpowiedź uzasadnij.
c)
Spośród reakcji, których równania przedstawiono poniżej, wybierz tę, do której mógłby odnosić się przedstawiony diagram. Zaznacz wybraną odpowiedź.
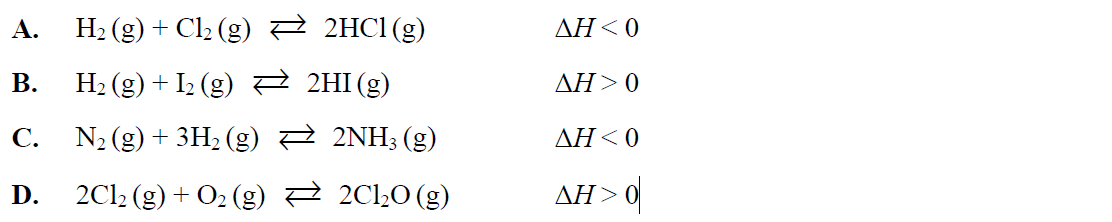
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!
a)
- Wnioskujemy, że w czasie reakcji układ oddaje energię do otoczenia, ponieważ zgodnie
z regułą przekory wydajność reakcji maleje ze wzrostem temperatury. - Reakcja jest egzoenergetyczna (lub egzotermiczna), ponieważ zgodnie z regułą przekory
wydajność reakcji maleje ze wzrostem temperatury. - Wnioskujemy, że w czasie reakcji układ oddaje energię do otoczenia, ponieważ wraz ze
wzrostem temperatury maleje procent objętości produktu w mieszaninie
b)
- W równaniu stechiometrycznym opisanej reakcji łączna liczba moli (gazowych)
substratów jest większa od liczby moli (gazowego) produktu, ponieważ zgodnie
z regułą przekory wydajność reakcji wzrasta ze wzrostem ciśnienia. - Wnioskujemy, że w opisanej reakcji łączna liczba moli substratów jest większa od liczby
moli produktu, ponieważ wraz ze wzrostem ciśnienia rośnie procent objętości produktu
w mieszaninie.
c)
Odpowiedź C
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!


