Amfoteryczność i związki kompleksowe
Cynk, magnez i glin w opisanych poniżej doświadczeniach ulegają przemianom zilustrowanym następującymi schematami:
W kolbach oznaczonych numerami I, II i III umieszczono w przypadkowej kolejności próbki cynku, magnezu i glinu. W każdej kolbie była próbka innego metalu. Na te metale podziałano kwasem solnym. Opisane doświadczenie zilustrowano poniższym schematem.
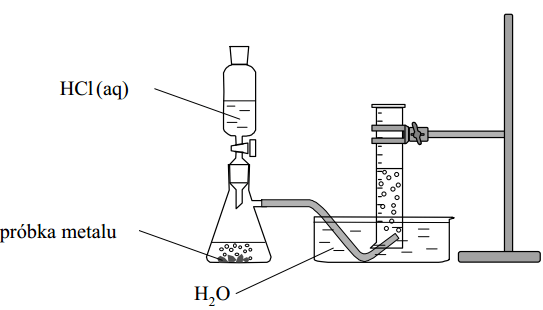
W celu identyfikacji roztworów chlorków otrzymanych w kolbach I, II i III przeprowadzono dwa doświadczenia. W pierwszym z nich jako odczynnika użyto wodnego roztworu wodorotlenku sodu, a w drugim – wodnego roztworu amoniaku.
a) Podczas pierwszego doświadczenia próbki roztworów z kolb I, II i III umieszczono w probówkach oznaczonych tymi samymi numerami i do każdej z nich dodawano kroplami roztwór wodorotlenku sodu. We wszystkich probówkach zaobserwowano wytrącenie się białego osadu. Podczas dodawania kolejnych porcji odczynnika zaobserwowano roztworzenie się osadów w probówkach I i III, natomiast osad w probówce II pozostał niezmieniony.
Podkreśl symbol metalu, którego jony zidentyfikowano podczas opisanego (pierwszego) doświadczenia. Uzasadnij swój wybór.
Metal, którego jony zidentyfikowano podczas opisanego doświadczenia, to (Al / Mg / Zn).
Uzasadnienie wyboru: .............................................................................................................................................................................................................................................................................................................................................................................................................................
b) Podczas drugiego doświadczenia próbki roztworów z kolb I i III umieszczono w probówkach oznaczonych tymi samymi numerami i do każdej z nich dodawano kroplami roztwór amoniaku. Najpierw w obu probówkach wytrącił się biały osad, ale przy dodawaniu kolejnych porcji odczynnika zaobserwowano roztworzenie się osadu w probówce I.
Napisz:
• w formie jonowej skróconej równanie reakcji, w wyniku której w probówce III wytrącił się biały osad;
......................................................................................................................................................
• w formie jonowej skróconej równanie reakcji, w wyniku której nastąpiło roztworzenie białego osadu w probówce I.
......................................................................................................................................................
a)Metal, którego jony zidentyfikowano podczas opisanego doświadczenia to (Al / Mg / Zn).
Uzasadnienie wyboru, np.:
Mg(OH)2 jako jedyny nie reaguje z NaOH.
lub
Powstały w reakcji Mg2+ + 2OH– → Mg(OH)2 wodorotlenek magnezu nie jest amfoteryczny i dlatego nie reaguje z nadmiarem NaOH. Natomiast wodorotlenki cynku i glinu to związki amfoteryczne.
lub
Mg(OH)2 ma charakter zasadowy.
b)• równanie reakcji, w wyniku której w probówce III wytrącił się biały osad
Al3++ 3NH3 ⋅ H2O → Al(OH)3(↓) + 3NH4+
lub
Al3++ 3NH3 + 3H2O → Al(OH)3(↓) + 3NH4+
lub
Al3+ + 3OH– → Al(OH)3(↓ )
• równanie reakcji, w wyniku której nastąpiło roztworzenie białego osadu w probówce I
Zn(OH)2 + 4NH3 · H2O → [Zn(NH3)4]2+ + 2OH − + 4H2O
lub Zn(OH)2 + 4NH3 → [Zn(NH3)4]2+ + 2OH −
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


