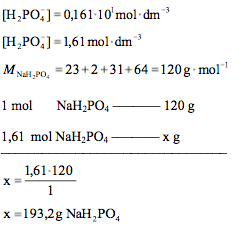Bufor fosforanowy – obliczenia
Bufory pH to roztwory zawierające sprzężoną parę kwas–zasada Brønsteda w podobnych stężeniach. Roztwory te mają zdolność do utrzymywania stałej wartości pH po dodaniu do nich niewielkich ilości mocnych kwasów lub zasad. Działanie buforu pH polega na tym, że po dodaniu mocnego kwasu zasada Brønsteda reaguje z jonami H3O+, a po dodaniu mocnej zasady kwas Brønsteda reaguje z jonami OH–. Przykładem roztworu buforowego jest bufor fosforanowy o składzie: NaH2PO4 + Na2HPO4, w zakresie pH = 5,5-8,0. Procesy, zachodzące w roztworze wodnym w opisanym buforze, można przedstawić za pomocą następującego równania reakcji chemicznej:
H2PO4- + H2O ⇄ HPO2-4 +H3O+
Oblicz, ile gramów NaH2PO4 należy dodać do roztworu zawierającego 0,10 mola Na2HPO4, aby po dopełnieniu wodą do objętości 1,00 dm3 pH otrzymanego roztworu buforowego wynosiło 6,00. Wartość stałej dysocjacji drugiego stopnia dla kwasu ortofosforowego (V) Ka2 jest równa 6,20 · 10−8. Uwzględnij fakt, że zapisując wyrażenie na stałą dysocjacji drugiego stopnia pomija się stężenie wody. Wynik podaj z dokładnością do jednego miejsca po przecinku.
| Obliczenia:
. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
Odpowiedź: Aby pH otrzymanego roztworu buforowego wynosiło 6,00 do roztworu należy dodać 193,2 g NaH2PO4.
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!