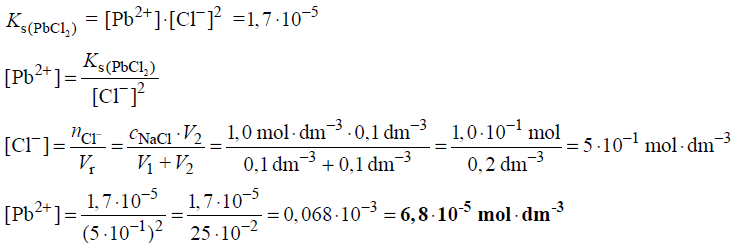Iloczyn rozpuszczalności – wspólny jon
Iloczyn rozpuszczalności Ks soli i wodorotlenków jest stałą równowagi dynamicznej, jaka ustala się między nierozpuszczoną substancją a jej roztworem nasyconym.
Chlorek ołowiu(II) jest związkiem trudno rozpuszczalnym w wodzie. Iloczyn rozpuszczalności tej soli wyraża się równaniem
Ks(PbCl2 ) = [Pb2+]⋅[Cl−]2
W temperaturze 298 K jego wartość jest równa 1,7⋅10−5.
Jeżeli stężenie jednego z jonów w roztworze się zmieni, np. przez rozpuszczenie innej substancji, która jest mocnym elektrolitem i dysocjuje z wytworzeniem takich jonów, zmienia się stężenie drugiego jonu, tak aby – zgodnie z regułą przekory – zachowana była stała wartość iloczynu rozpuszczalności.
Przygotowano 100 cm3 nasyconego wodnego roztworu chlorku ołowiu(II) o temperaturze 298 K. Do przygotowanego roztworu dodano 100 cm3 wodnego roztworu chlorku sodu o stężeniu 1,0 mol⋅dm−3.
Oblicz stężenie molowe jonów ołowiu(II) w roztworze otrzymanym w opisany powyżej sposób w temperaturze 298 K. W obliczeniach pomiń stężenie jonów chlorkowych pochodzących od trudno rozpuszczalnej soli.
Obliczenia:
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.