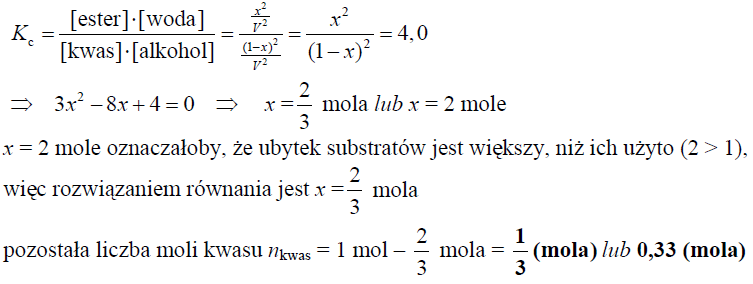Oblicz, ile moli kwasu etanowego pozostało w mieszaninie po ustaleniu się stanu równowagi
Reakcja kwasu etanowego (octowego) z etanolem prowadzona w obecności mocnego kwasu jest reakcją odwracalną, która przebiega według równania:
CH3COOH + CH3CH2OCH ←H+→CH3COOCH2CH3 + H2O
Stężeniowa stała równowagi tej reakcji w temperaturze 25 °C wynosi Kc = 4,0.
Badając kinetykę reakcji kwasu etanowego z etanolem w środowisku wodnym, stwierdzono, że względny rząd reakcji dla etanolu i kwasu etanowego wynosi 1, a całkowity rząd reakcji jest równy 2. Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
W naczyniu o objętości V zmieszano w temperaturze 25 °C 1 mol kwasu etanowego i 1 mol etanolu. Do otrzymanej mieszaniny dodano niewielką ilość stężonego kwasu siarkowego(VI).
Oblicz, ile moli kwasu etanowego pozostało w mieszaninie po ustaleniu się stanu równowagi.
Obliczenia:
Odpowiedź:
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.