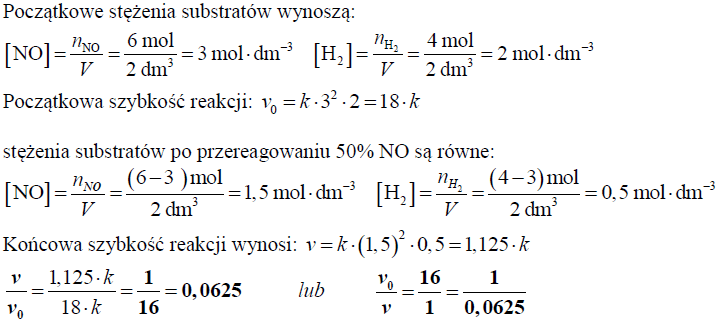Obliczanie stosunku szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości substratu
Reakcja redukcji tlenku azotu(II) wodorem przebiega zgodnie z równaniem:
2NO(g) + 2H2(g) → N2(g) + 2H2O(g)
Szybkość tej reakcji wyraża się następującym równaniem kinetycznym:
v = k ⋅ [NO]2 ⋅[H2]
W tym równaniu k jest współczynnikiem proporcjonalności zwanym stałą szybkości reakcji, [NO] i [H2] oznaczają stężenia molowe odpowiednio tlenku azotu(II) i wodoru. Stała szybkości k jest charakterystyczna dla danej reakcji, zależy od temperatury, ale nie zależy od stężenia substratów.
W zamkniętym reaktorze o pojemności 2 dm3 zmieszano 6 moli tlenku azotu(II) i 4 mole wodoru. Podczas reakcji utrzymywano stałą temperaturę.
Oblicz stosunek szybkości opisanej reakcji w chwili, gdy przereaguje 50% początkowej ilości tlenku azotu(II), do szybkości początkowej tej reakcji.
Obliczenia:
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.