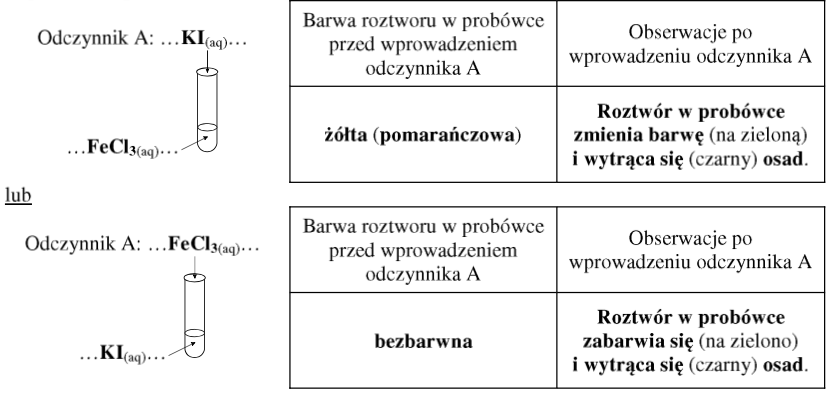
Półogniwa- obserwacje doświadczenia
Miarą aktywności chemicznej pierwiastka jest wartość standardowego potencjału reakcji redoks, E°, podawana w woltach (V). Wartości te, dla różnych półogniw podaje szereg elektrochemiczny. Półogniwo to układ, w którym reagują dwie formy: utleniona i zredukowana pierwiastka lub jonu, co można zapisać w postaci schematycznej, np.: (Sn2+/Sn4+), a interpretuje się w jonowo-elektronowym zapisie równania reakcji z udziałem wymienionych w schemacie cząsteczek lub jonów. Im mniejsza wartość potencjału tym chętniej atomy pierwiastka (lub cząsteczki, czy jony) uczestniczą w procesie utleniania, a im większa wartość potencjału tym chętniej uczestniczą w procesie redukcji. Wynika stąd, że wartość potencjału jest wskaźnikiem samorzutnego, spontanicznego kierunku reakcji utleniania bądź redukcji. Reakcja zachodząca między jonami miedzi (II) a atomami cynku jest samorzutna, czyli przebiega jako:
Cu2+ + Zn → Zn2+ + Cu,
gdyż wartość potencjału półogniwa E° (Cu/Cu2+) ma wartość większą od potencjału półogniwa E° (Zn/Zn2+), zatem umieszczenie w roztworze soli miedzi (II) płytki cynkowej spowoduje zachodzenie spontanicznej reakcji redukcji jonów miedzi (II): Cu2+ + 2e– → Cu oraz spontanicznej reakcji utleniania cynku: Zn → Zn2+ + 2e–. Te dwie reakcje jonowo elektronowe, zsumowane, dają jonowe równanie procesu utleniania-redukcji.
Na podstawie: A. Bielański, Podstawy chemii nieorganicznej, T1, rozdz. 12, wyd. 6, PWN, Warszawa, 2010
Na podstawie zapisanego równania reakcji biegnącej z udziałem cząsteczek I2 oraz jonów: I–, Fe2+ i Fe3+ opisz obserwacje do tego doświadczenia. W tym celu uzupełnij schemat doświadczenia wzorami wybranych odczynników oraz tabelę. Przyjmij, że mieszanina substratów w doświadczeniu była stechiometryczna.
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!