Reakcja rozkładu nadtlenku wodoru- doświadczenie
Energia aktywacji określa wielkość bariery energetycznej, którą muszą pokonać reagujące drobiny, aby doszło do reakcji chemicznej. Im mniejsza jest energia aktywacji dla danej reakcji, tym szybciej zachodzi przemiana. Dużą energię aktywacji reakcji można zmniejszyć, jeżeli wprowadzi się do układu katalizator.
Nadtlenek wodoru ulega reakcji rozkładu według równania:
2H2O2 → 2H2O + O2
W temperaturze pokojowej szybkość rozkładu H2O2 jest mała. W poniższej tabeli podano wartości energii aktywacji reakcji rozkładu H2O2 bez udziału katalizatora oraz z udziałem różnych katalizatorów.
 Przeprowadzono doświadczenie zilustrowane poniższym schematem.
Przeprowadzono doświadczenie zilustrowane poniższym schematem.
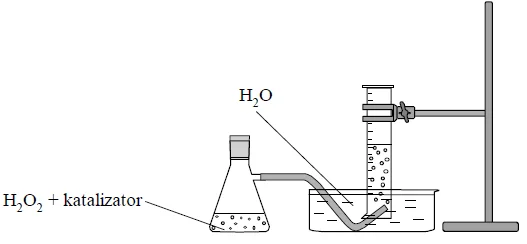 Uzupełnij poniższe zdania. W każdym nawiasie wybierz i podkreśl właściwe określenie.
Uzupełnij poniższe zdania. W każdym nawiasie wybierz i podkreśl właściwe określenie.
Podczas doświadczenia zaobserwowano wydzielanie (barwnego / bezbarwnego) gazu, który (dobrze / słabo) rozpuszcza się w wodzie. Po umieszczeniu w probówce z zebranym gazem tlącego się łuczywka zapala się ono jasnym płomieniem, co świadczy o tym, że otrzymany gaz (jest palny / podtrzymuje palenie).
Podczas doświadczenia zaobserwowano wydzielanie (barwnego / bezbarwnego) gazu, który (dobrze / słabo) rozpuszcza się w wodzie. Po umieszczeniu w probówce z zebranym gazem tlącego się łuczywka zapala się ono jasnym płomieniem, co świadczy o tym, że otrzymany gaz (jest palny / podtrzymuje palenie).
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


