Reakcje soli manganu
Przeprowadzono doświadczenie, którego przebieg zilustrowano na schemacie.
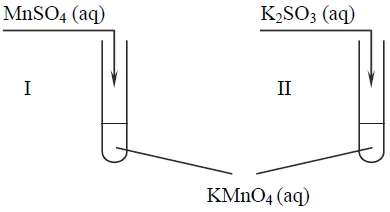 W obu probówkach wytrącił się brunatny osad.
W obu probówkach wytrącił się brunatny osad.
a) Napisz w formie jonowej z uwzględnieniem oddawanych lub pobieranych elektronów (zapis jonowo-elektronowy) równania procesu redukcji i procesu utleniania zachodzących w probówce I podczas opisanego doświadczenia. Uwzględnij fakt, że jednym z substratów obu procesów jest woda.
Równanie procesu redukcji:
......................................................................................................................................................
Równanie procesu utleniania:
......................................................................................................................................................
b) Oceń, jaki jest odczyn roztworu po zakończeniu reakcji w probówce I, oraz podaj nazwę anionu zawierającego siarkę, który powstał w wyniku reakcji chemicznej przebiegającej w probówce II.
Odczyn roztworu po reakcji w probówce I: ................................................................................
Nazwa anionu zawierającego siarkę: ..........................................................................................
a) Równanie procesu redukcji:
MnO4– + 2H2O+ 3e– →MnO2 +4OH– (| x 2)
Równanie procesu utleniania:
Mn2+ + 2H2O→ 4H+ +MnO2 + 2e– (| x 3)
b) Odczyn roztworu po reakcji w probówce I: kwasowy
lub 2MnO4– +3Mn2+ + 2H2O →5MnO2 +4H+
Nazwa anionu zawierającego siarkę: siarczanowy(VI)
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


