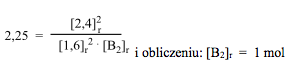Równowaga reakcji
W temperaturze T stała równowagi reakcji odwracalnej: 2A + B2 ⇄ 2AB, zachodzącej w fazie gazowej, w układzie o objętości 1 dm3, jest równa 2,25. Początkowe stężenie substancji A wynosiło 4 mol · dm–3.
Oblicz, ile moli substancji B2 należy wprowadzić do układu, aby 60% substancji A uległo przemianie do związku AB.
| Obliczenia: |
4 mol A – 100%
x – 60%
x = 2,4 mol A
2A + B2 = 2AB
2 mol – 1 mol – 2 mol
2,4 mol – y – z
y = 1,2 mol
z = 2,4 mol
(Bilans materiałowy reagentów, można zastosować w oparciu o pojęcie mola, ze względu na objętość reaktora wynoszącą 1 dm3🙂
|
Początkowa liczba moli |
Zmiana liczby moli |
Równowagowa liczba moli |
|
| A | 4 | -2,4 | 1,6 |
| B2 | x | -1,2 |
[B2]r |
| AB | 0 | +2,4 | 2,4 |
(Obliczanie liczby moli substancji B2 w stanie równowagi, na podstawie wyrażenia na stałą równowagi Kc. Wyrażenie na stałą równowagi dla podanej reakcji ma postać:)
Gdzie [AB]r, [A]r, [B2]r oznaczają stężenia molowe odpowiednich substancji w stanie równowagi. Po podstawieniu:
W oparciu o tabelę bilansu materiałowego:
x – 1,2 = 1
x = 2,2
Odpowiedź: Do układu należy wprowadzić 2,2 mola substancji B2, aby 60% substancji A uległo reakcji do osiągnięcia stanu równowagi.
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!