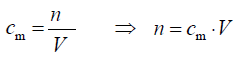Stężenie molowe i osad po zmniejszeniu objętości rozpuszczalnika
Wodny roztwór KNO3 o stężeniu 2,0 mol · dm−3 i gęstości 1,12 g · cm−3 pozostawiono w otwartym naczyniu w temperaturze 80 ºC. Rozpuszczalność KNO3 w temperaturze 80 ºC wynosi około 170 g w 100 g wody.
Na podstawie odpowiednich obliczeń oceń, czy zmniejszenie objętości roztworu z 200 cm3 do 190 cm3 wywołane parowaniem rozpuszczalnika poskutkuje pojawieniem się osadu w naczyniu. Uzasadnij swoją ocenę.
 Uzasadnienie:
Uzasadnienie:
………………………………………………………………………………………………………………………………………………………………………………………………….………………………………………………………………………………………………….......................
V = 200 cm3 = 0,20 dm3
KNO3 M = 101 g · mol–1
n = 2,0 mol · dm–3 ·0, 20 dm3 = 0, 4 mola ⇒ m =101 g · mol–1· 0,4 mol = 40,40 g
mr = 200 cm3· 1,12 g · cm–3 = 224 g
m wody(1) = 224 g – 40,40 g = 183,6 g
masa wody po odparowaniu
m wody(2) = 183,6 g – 10 g = 173,6 g
obliczenie ilości soli przypadającej na 100 g wody w roztworze po odparowaniu 10 cm3 wody
40,40 g soli — 173,6 g wody
x g soli — 100,0 g wody
x = 23,3 g -> msoli = 23,3 g
Ocena:
W naczyniu nie pojawi się osad.
Uzasadnienie:
Po odparowaniu wody roztwór będzie nienasycony (rozpuszczalność KNO3 w temperaturze 80 ºC wynosi około 170 g w 100 g wody).
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.