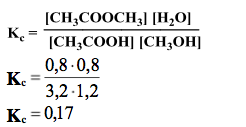Stężeniowa stała równowagi po przereagowaniu 40% kwasu w ester
Do reaktora o objętości 1 dm3 wprowadzono 2 mole kwasu etanowego (octowego) i 4 mole metanolu. Po dodaniu katalizatora zainicjowano reakcję estryfikacji, opisaną równaniem:
Po przereagowaniu 40% kwasu karboksylowego w ester, ustalił się stan równowagi chemicznej.
Oblicz stężeniową stałą równowagi Kc. Wynik podaj z dokładnością do dwóch miejsc po przecinku.
| Obliczenia:
Odpowiedź: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
I. etap:
2 mole – 100% kwasu
x – 40 % kwasu
x = 0,8 mola kwasu uległo reakcji
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!