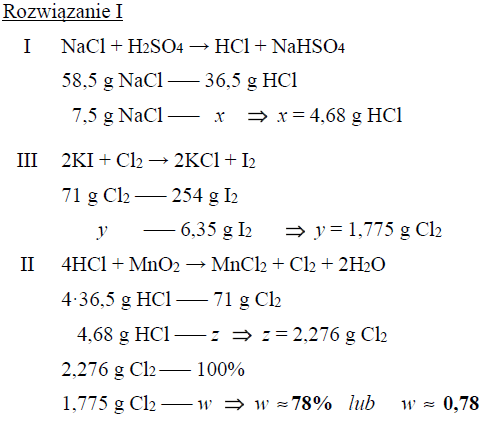Sumaryczna wydajność reakcji
Próbkę stałego chlorku sodu o masie 7,5 g poddano działaniu stężonego kwasu siarkowego(VI). Zaszła wówczas reakcja opisana równaniem:
I) NaCl + H2SO4 → HCl + NaHSO4
Tę reakcję prowadzono aż do całkowitego zużycia chlorku sodu. Otrzymany w tej reakcji chlorowodór zebrano, rozpuszczono w wodzie i poddano działaniu tlenku manganu(IV), w wyniku czego zaszła reakcja zgodnie z równaniem:
II) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
Powstały w tej przemianie chlor wprowadzono do wodnego roztworu jodku potasu i otrzymano 6,35 grama jodu zgodnie z równaniem:
III) 2KI + Cl2 → 2KCl + I2
Oblicz wydajność przemiany II, jeżeli przemiany I i III zaszły z wydajnością równą 100%.
Obliczenia:
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.