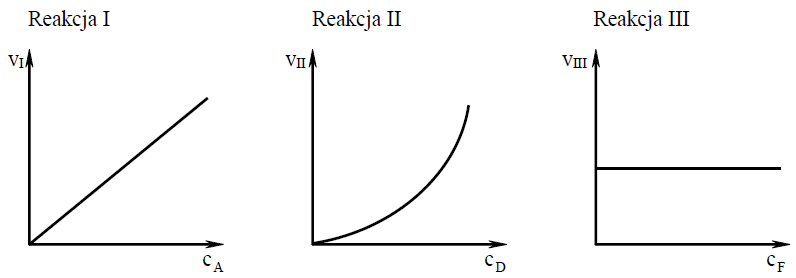
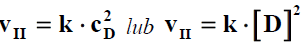Szybkość i rząd reakcji
Badano szybkość trzech reakcji chemicznych zachodzących zgodnie z równaniami:
Reakcja I: A → B
Reakcja II: 2D → E
Reakcja III: F + G → H
Na wykresach przedstawiono zależność szybkości tych reakcji od stężeń molowych ich substratów oznaczonych symbolami A, D i F.
vI, vII, vIII – szybkości reakcji I, II i III
cA , cD , cF – stężenia molowe substratów A, D i F
Rząd reakcji ze względu na wybrany substrat to wykładnik potęgi, w której stężenie molowe danego substratu występuje w równaniu kinetycznym tej reakcji.
a) Przeanalizuj powyższe wykresy i uzupełnij tabelę, określając rząd reakcji I ze względu na substrat A oraz rząd reakcji III ze względu na substrat F.
b) Dokończ poniższy zapis, tak aby otrzymać równanie kinetyczne reakcji II.
vII = k·................
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.