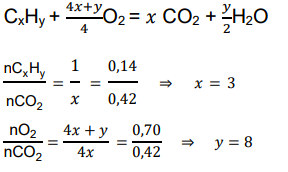Ustalanie wzoru sumarycznego węglowodoru
Do całkowitego spalenia próbki zawierającej 8,43 · 1022 cząsteczek pewnego węglowodoru zużyto 15,68 dm3 tlenu odmierzonego w warunkach normalnych. W reakcji wydzieliło się 18,48 g tlenku węgla (IV).
Ustal na podstawie obliczeń wzór sumaryczny tego węglowodoru.
| Obliczenia:
Wzór sumaryczny: . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . |
Sposób1
liczba moli węglowodoru CxHy:
6,02 · 1023 – 1 mol
8,43 · 1022 – x mola
x = 0,14 mola
liczba moli tlenu:
22,40 dm3 – 1 mol
15,68 dm3 – x mola
x = 0,70 mola
liczby moli CO2:
44,01 g – 1 mol
18,48 g – x mola
x = 0,42 mola
liczba atomów węgla i wodoru w cząsteczce CxHy:
Wzór: C3H8
Sposób 2
CxHy + O2 -> CO2 + H2O
nCxHy = 0,14 mol
nO2 = 0,70 mol
nCO2 = 0,42 mol
liczba moli CO2 jest taka sama jak liczba moli atomów węgla w CxHy
nCxHy/nCO2 = 0,14/0,42 = 1/3
liczba moli CO2 w równaniu = 3
liczba moli CxHy w równaniu 1, x=3
nCxHy/nO2 = 0,14/0,70 = 1/5
liczba moli O2 w równaniu = 5
Zatem mamy równanie:
C3Hy + 5O2 -> 3CO2 + ? H2O
liczbę moli H2O można ustalić zauważając, że po stronie substratów mamy 5O2, czyli 10 at. O, a po stronie produktów w 3CO2 mamy 6 at. O, więc do 10 potrzebujemy jeszcze 4 at. O. W związku z tym przed H2O wpisujemy 4.
C3Hy + 5O2 -> 3CO2 + 4H2O
W 4 molach H2O znajduje się 8 moli at. H, więc y=8.
Wzór związku to C3H8
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.