Wpływ wzrostu temperatury na wydajność reakcji
W procesie parowego reformingu metanu (konwersji metanu z parą wodną) w pierwszym etapie ten gaz reaguje z parą wodną w obecności katalizatora niklowego – w temperaturze około 1070 K i pod ciśnieniem około 3 · 104 hPa – zgodnie z równaniem:
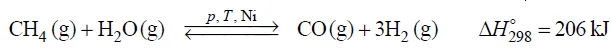 Pomimo że stechiometryczny stosunek molowy substratów reakcji jest równy 1, ten proces prowadzi się przy nadmiarze pary wodnej.
Pomimo że stechiometryczny stosunek molowy substratów reakcji jest równy 1, ten proces prowadzi się przy nadmiarze pary wodnej.
a) Określ, czy wzrost temperatury wpływa na zwiększenie wydajności opisanej reakcji konwersji, jeżeli zachodzi ona pod stałym ciśnieniem p, oraz czy wzrost ciśnienia skutkuje wzrostem wydajności tej reakcji. Odpowiedź uzasadnij.
Wpływ wzrostu temperatury na wydajność reakcji (p = const) i uzasadnienie:
.................................................................................................................................................................................................................................................................................................................................................................
Wpływ wzrostu ciśnienia na wydajność reakcji (T = const) i uzasadnienie:
..................................................................................................................................................................................................................................................................................................................................................................
b) Szybkość opisanej reakcji wzrasta ze wzrostem ciśnienia. Poniżej zestawiono warunki, w jakich przeprowadza się opisany proces parowego reformingu metanu:
I temperatura około 1070 K
II ciśnienie około 3 · 104 hPa
III katalizator niklowy
IV stosunek molowy nH2O : nCH4 > 1
Dokończ poniższe zdania – wpisz numery wszystkich warunków prowadzenia procesu, które wpływają na szybkość i wydajność konwersji metanu.
1. Warunki sprzyjające dużej szybkości reakcji: ......................................................................
2. Warunki sprzyjające dużej wydajności reakcji: ....................................................................
a) Wpływ wzrostu temperatury na wydajność reakcji (p = const) i uzasadnienie:
Tak, wzrost temperatury powoduje zwiększenie wydajności tworzenia CO i H2, ponieważ przemiana ta jest endotermiczna (ΔH > 0). Zgodnie z regułą przekory wydajność reakcji endotermicznej wzrasta ze wzrostem temperatury.
Wpływ wzrostu ciśnienia na wydajność reakcji (T = const) i uzasadnienie:
Nie, wzrost ciśnienia nie skutkuje wzrostem wydajność przemiany metanu, ponieważ łączna liczba moli gazowych substratów jest mniejsza od łącznej liczby moli gazowych produktów. Wzrost ciśnienia powoduje zmniejszenie wydajności tej przemiany.
b)
1. Warunki sprzyjające dużej szybkości reakcji: I, II, III.
2. Warunki sprzyjające dużej wydajności reakcji: I, IV
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


