Zadanie 7, arkusz czerwiec 2022
W roztworach wodnych między jonami a dipolami wody występują oddziaływania przyciągające, które powodują, że jony ulegają hydratacji, czyli wiążą się z otaczającymi je cząsteczkami wody.
Cząsteczki wody związane z kationem metalu wykazują zdolność odszczepiania protonu, która jest tym większa, im mniejszy jest promień kationu metalu i im większy jest jego ładunek. Hydratowany kation glinu ulega dysocjacji kwasowej zgodnie z poniższym równaniem:
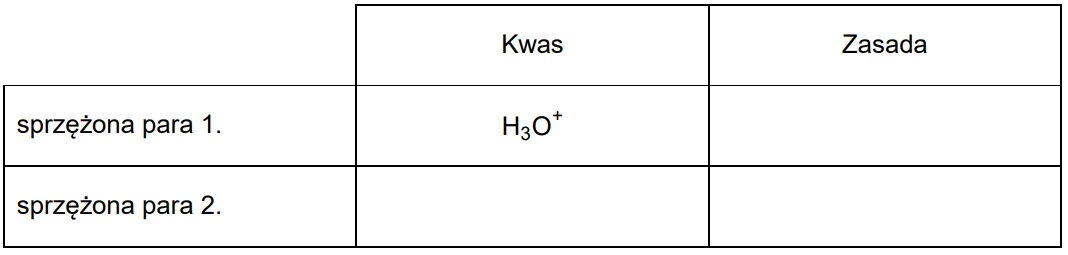
[Al(H2O)6]3+ + H2O ⇄ [Al(H2O)5(OH)]2+ + H3O+
Stała dysocjacji kwasowej [Al(H2O)6]3+ w temperaturze 298 K jest równa 1,4 ∙ 10–5.
Na podstawie: J. McMurry, R.C. Fay, Chemistry, Upper Saddle River 2001.
zadanie 7.1.
Dla przemiany zilustrowanej powyższym równaniem napisz wzory kwasów i zasad Brønsteda, tworzących w tej reakcji sprzężone pary.
Zadanie 7.2.
Oceń prawdziwość poniższych zdań. Zaznacz P, jeżeli zdanie jest prawdziwe, albo F – jeśli jest fałszywe.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.