Zadanie 8, arkusz maj 2023
W wodnych roztworach słabych kwasów jednoprotonowych zachodzi dysocjacja. Dla danej wartości stężenia molowego roztworu i w danej temperaturze ustala się stan równowagi między cząsteczkami i jonami obecnymi w roztworze.
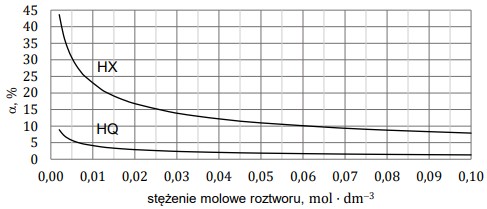
Na poniższym wykresie przedstawiono zależność stopnia dysocjacji (α) dwóch kwasów jednoprotonowych HX i HQ od stężenia molowego roztworu w temperaturze 20 °C.
Wartości stopnia dysocjacji kwasu HX dla wybranych stężeń molowych (𝑐0) zebrano w tabeli (𝑡 = 20 °C).
W tabeli (s. 9) umieszczono wartości pH czterech roztworów kwasu HX o wybranych stężeniach molowych, a na wykresie przedstawiono logarytmiczną zależność pH roztworu tego kwasu od jego stężenia molowego w zakresie stężeń od 0,002 mol · dm−3 do 0,028 mol · dm−3 (𝑡 = 20 °C).
Uzupełnij tabelę brakującymi wartościami pH (z dokładnością do jednego miejsca po przecinku) oraz dokończ wykres zależności pH roztworu kwasu HX od jego stężenia molowego. Następnie oblicz stężenie molowe jonów X− i stężenie molowe niezdysocjowanych cząsteczek HX w roztworze o pH = 𝟐, 𝟐. Odczyt z wykresu wykonaj z dokładnością do 𝟎, 𝟎𝟎𝟐 𝐦𝐨𝐥 · 𝐝𝐦−𝟑, a wartości stężenia molowego jonów X− i cząsteczek HX podaj z dokładnością do 𝟎, 𝟎𝟎𝟏 𝐦𝐨𝐥 · 𝐝𝐦−𝟑.
Sposób 1.
[H+] = 𝛼 ∙ 𝑐0 oraz pH = – log[H+]
Uwaga: Poprawnie narysowany wykres musi zawierać 2 poprawnie naniesione punkty (na przecięciu odpowiednich linii siatki). Punkty muszą być połączone krzywą lub odcinkami. Za poprawny należy uznać każdy odczyt adekwatny do wykonanego wykresu i dokonany z właściwą dokładnością.
pH = 2,2 ⇒ 𝑐0 = 0,068 mol ∙ dm–3 (wartość odczytana z wykresu)
[H+] = [X–] = 10–2,2 mol ∙ dm–3 = 𝟎, 𝟎𝟎𝟔 𝐦𝐨𝐥 ∙ 𝐝𝐦–𝟑
[HX] = 𝑐0 – [H+] = (0,068 – 0,006) mol ∙ dm–3 = 𝟎, 𝟎𝟔𝟐 𝐦𝐨𝐥 ∙ 𝐝𝐦–3
W roztworze o pH = 2,2 stężenie molowe jonów X– jest równe 𝟎, 𝟎𝟎𝟔 𝐦𝐨𝐥 ∙ 𝐝𝐦–𝟑, a stężenie molowe niezdysocjowanych cząsteczek kwasu HX jest równe 𝟎, 𝟎𝟔𝟐 𝐦𝐨𝐥 ∙ 𝐝𝐦–𝟑.
Sposób 2.
[H+] = [X–] = 10–2,2 mol ∙ dm–3 = 𝟎, 𝟎𝟎𝟔 𝐦𝐨𝐥 ∙ 𝐝𝐦–3
Obliczenie wartości stałej dysocjacji 𝐾 na podstawie danych zawartych w informacji do zadania i obliczenie wartości stężenia molowego roztworu, w którym stężenie jonów [H+] ma wartość 0,006 mol ∙ dm–3
dane odczytane z dowolnej kolumny tabeli, np.: 𝛼 = 25,2 %, 𝑐0 = 0,0080 mol ∙ dm–3
K = (𝛼2 ∙ c0) : (1 – 𝛼) ⇒ 𝐾 = 6,79 ∙ 10–4
K = (𝛼2 ∙ c0) : (1 – 𝛼) ⇒ c0 = ([H+]2 + K ∙ [H+]) : K ⇒ c0 = = 0,060 mol ∙ dm–3
[HX] = 𝑐0 – [H+]
[HX] = (0,060 – 0,006) mol ∙ dm–3 = 𝟎, 𝟎𝟓𝟒 𝐦𝐨𝐥 ∙ 𝐝𝐦–3
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.