Zadanie 9, arkusz pokazowy marzec 2022
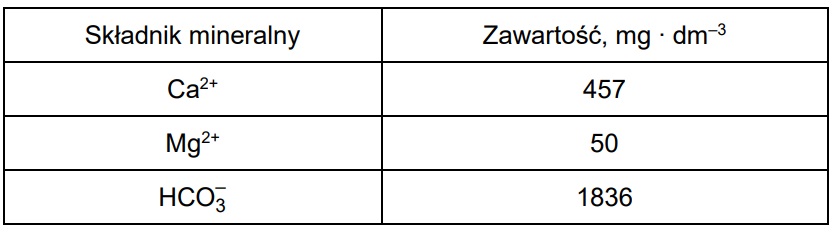
W pewnej wodzie mineralnej znajdują się jony: Ca2+, Mg2+ oraz HCO3–. Ich zawartość przedstawiono w poniższej tabeli.
Podczas gotowania 1000 cm3 tej wody mineralnej zaobserwowano powstanie białego osadu. W opisanych warunkach przebiegły reakcje opisane równaniami:
Ca2+ + 2HCO3– → CaCO3 + CO2 + H2O
Mg2+ + 2HCO3– → MgCO3 + CO2 + H2O
Oblicz, jaki procent masy wydzielonego osadu stanowi masa węglanu magnezu. Przyjmij, że obie reakcje zachodzą z wydajnością równą 100 %, a powstały osad składa się wyłącznie z węglanu wapnia i węglanu magnezu.
𝑚Ca2+ = 457 mg = 0,457 g ⇒ nCa2+ = 0,457 g : ( 40 g ∙ mol–1 ) = 0,011425 mol
𝑚Mg2+ = 50 mg = 0,050 g ⇒ 𝑛Mg2+ = 0,050 g : ( 24 g ∙ mol–1 ) = 0,002083 mol
𝑚HCO3– = 1836 mg = 1,836 g ⇒ 𝑛HCO3– = 1,836 g : ( 61 g ∙ mol–1 ) = 0,030098 mol
Ponieważ: 2·(0,011425 + 0,002083) mol < 0,030098 mol, to powstanie:
𝑛CaCO3= 0,011425 mol ⇒ 𝑚CaCO3= 0,011425 mol · 100 g·mol–1 = 1,1425 g
𝑛MgCO3= 0,002083 mol ⇒ 𝑚MgCO3= 0,002083 mol · 84 g·mol–1 = 0,1750 g
% MgCO3 = 0,1750 g : (0,1750+1,1425) g · 100 % = 13,3 (%)
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.