Konfiguracja elektronowa – identyfikacja pierwiastka
Z konfiguracji elektronowej atomu (w stanie podstawowym) pierwiastka X wynika, że w tym atomie:
• elektrony rozmieszczone są na czterech powłokach elektronowych
• na podpowłoce 3d liczba elektronów sparowanych jest dwa razy mniejsza od liczby elektronów niesparowanych.
a) Podaj symbol pierwiastka X, dane dotyczące jego położenia w układzie okresowym oraz symbol bloku konfiguracyjnego (energetycznego), do którego należy pierwiastek X.

b) Uzupełnij poniższy zapis (stosując schematy klatkowe), tak aby przedstawiał on konfigurację elektronową atomu w stanie podstawowym pierwiastka X. W zapisie tym uwzględnij numery powłok i symbole podpowłok. Podkreśl ten fragment konfiguracji, który nie występuje w konfiguracji elektronowej jonu X2+ (stan podstawowy).

a)
Symbol: Fe
Numer okresu: 4
Numer grupy: 8
Blok energetyczny: d

b)
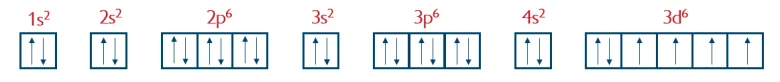 W konfiguracji elektronowej jonu X2+ nie występuje poziom 4s2 i ten właśnie należy w zadaniu podkreślić.
W konfiguracji elektronowej jonu X2+ nie występuje poziom 4s2 i ten właśnie należy w zadaniu podkreślić.
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.


