Sole
Sole kwasów tlenowych można otrzymywać wieloma metodami. Wśród nich można wymienić reakcje:
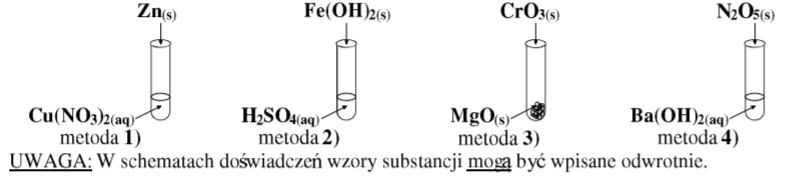
metoda 1) soli z metalem,
metoda 2) kwasu z wodorotlenkiem,
metoda 3) tlenku kwasowego z tlenkiem metalu w podwyższonej temperaturze,
metoda 4) tlenku kwasowego z wodorotlenkiem.
Przygotowano zestaw odczynników, których użyto do otrzymywania soli wymienionymi metodami:
Zn(s) , H2SO4(aq) , N2O5(s), Ba(OH)2(aq), CrO3(s), Cu(NO3)2(aq), MgO(s), Fe(OH)2(s)
Do doświadczeń użyto reagentów w stosunku molowym 1:1, a reakcje przebiegały ze 100% wydajnością.
a) Dobierz odczynniki z podanego zestawu i wpisz ich wzory w odpowiednich miejscach na poniższych schematach 1) – 4) tak, aby można było otrzymać rozpuszczalne (t= 25 °C) w wodzie sole wymienionymi metodami.

b) Zapisz jonowe (zapis skrócony) równania reakcji zachodzących według metod: 1) i 2), a cząsteczkowe równania reakcji zachodzących według metod: 3) i 4).
Jonowe równania reakcji (zapis skrócony):
1) …………………………………………………………………………………………………
2) …………………………………………………………………………………………………
Cząsteczkowe równania reakcji:
3) …………………………………………………………………………………………………
4) …………………………………………………………………………………………………
c)
Do mieszanin poreakcyjnych w probówkach wprowadzono po 10 cm3 wody destylowanej.
Przypisz do poniższych stwierdzeń oznaczenia (np.: 1) i 4) ) wszystkich probówek, w których nastąpiły opisane zmiany, aby powstałe w ten sposób zdania były prawdziwe.
a. Roztwór barwy bladozielonej uzyskano w probówce (probówkach): ……………………….
b. Bezbarwny roztwór uzyskano w probówce (probówkach): ……………………….
c. Po dodaniu do mieszaniny poreakcyjnej kilku kropli stężonego HNO3 nastąpiła zmiana barwy w probówce (probówkach): ……………………….
a)
b)
1) Zn + Cu2+ → Zn2+ + Cu
2) Fe(OH)2 + 2H+ → Fe2+ + 2H2O
3) MgO + CrO3 →MgCrO4
4) Ba(OH)2 + N2O5 → Ba(NO3)2 + H2O
c)
a) Metoda 2
b) Metoda 1 i 4
b) Metoda 1, 2, 3
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!


