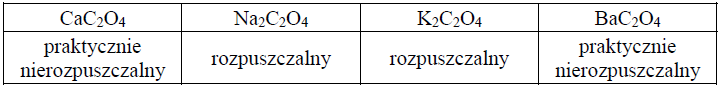Szczawian magnezu – rozpuszczalność
Kwas szczawiowy (etanodiowy) to najprostszy kwas dikarboksylowy o wzorze sumarycznym H2C2O4. Szczawian magnezu MgC2O4 jest bezbarwnym krystalicznym ciałem stałym, które trudno rozpuszcza się w wodzie. Kationy magnezu mają zdolność tworzenia z anionami szczawianowymi jonów kompleksowych o wzorze [Mg(C2O4)2]2–. Sole zawierające ten jon są rozpuszczalne w wodzie.
W poniższej tabeli przedstawiono informacje o rozpuszczalności w wodzie szczawianów wybranych metali w temperaturze pokojowej.
a) Sformułuj hipotezę na temat zachowania szczawianu magnezu w kontakcie z roztworem zawierającym jony szczawianowe. Uwzględnij wytrącanie lub roztwarzanie związków magnezu.
..................................................................................................................................................................................................................................................................................................................................................................
b) Zaprojektuj doświadczenie, którego przebieg potwierdzi sformułowaną hipotezę. Uzupełnij poniższy schemat − wpisz wzory soli wybranych spośród następujących:
− CaC2O4
− K2C2O4
− MgCl2
− MgCO3
c) Napisz w formie jonowej skróconej równania reakcji zachodzących w czasie doświadczenia.
.................................................................................................................................................................................
a) Osad szczawianu magnezu roztworzy się lub rozpuści się w roztworze zawierającym jony szczawianowe.
b) 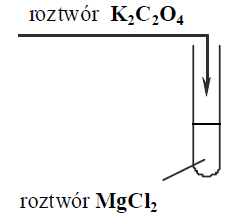 Dodawanie odczynników w odwrotnej kolejności należy uznać za poprawne.
Dodawanie odczynników w odwrotnej kolejności należy uznać za poprawne.
c) Mg2++ C2O42– → MgC2O4
MgC2O4 + C2O42–→ [Mg(C2O4)2]2–
Załóż bezpłatne konto, aby uzyskać dostęp do rozwiązania tego zadania.