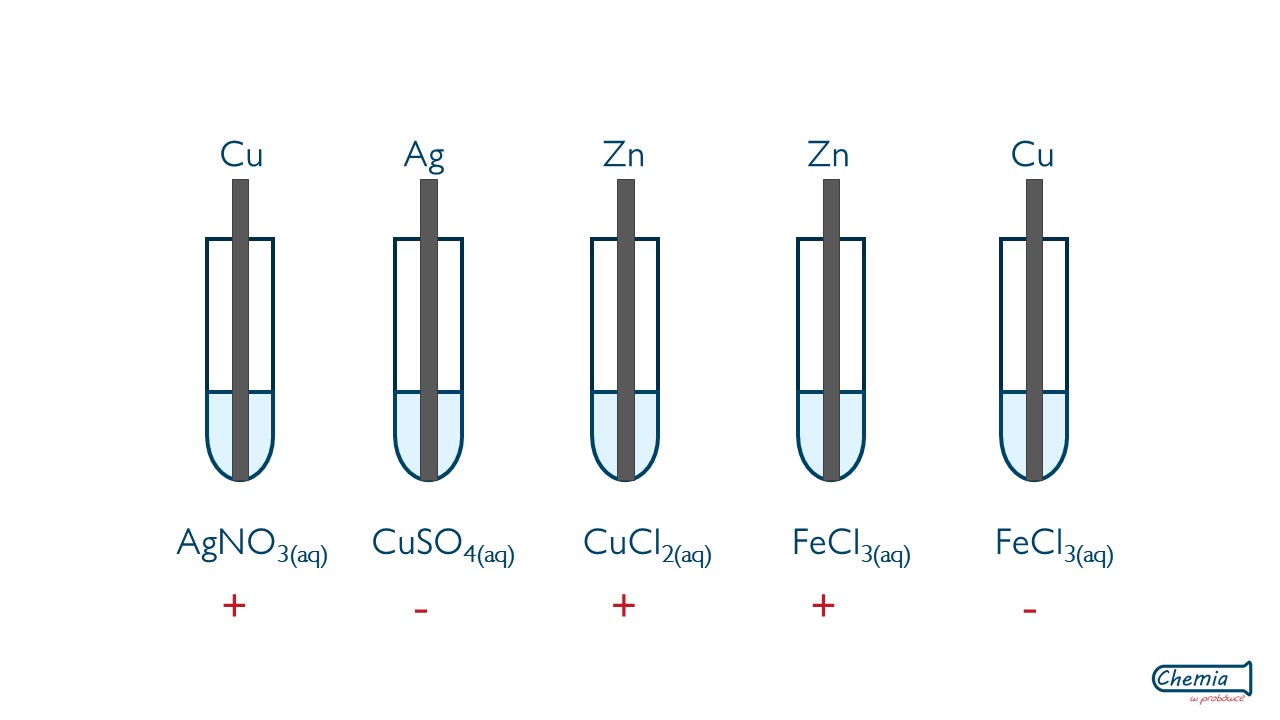
Aktywność metali
Przeprowadzono doświadczenia chemiczne widoczne na schematach:
Znakiem "+" oznaczono probówki, w których zaszła reakcja, a znakiem "-" oznaczone te, w których reakcja nie zaszła.
- Zapisz zachodzące reakcje w formie jonowej skróconej
- Opisz obserwacje jakie zachodzą w probówkach oznaczonych znakiem "+"
- Analizując przebieg doświadczeń dokończ zdanie : aktywność metali Ag, Zn, Cu, Fe maleje w szeregu ...........>..........>...........>...........
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!
Cu + 2Ag+ → Cu2+ + 2Ag
Zn + Cu2+ → Zn2+ + Cu
3Zn + 2Fe3+ → 3Zn2+ + 2Fe
W pierwszej probówce roztwór zabarwi się na niebiesko w wyniku powstania jonów Cu2+ oraz zauważymy pokrywanie się blaszki miedzianej srebrnym nalotem – metalicznym srebrem.
W trzeciej probówce obserwujemy osadzanie się miedzianego nalotu na blaszce oraz odbarwianie się roztworu. Jony miedzi (II) obecne w roztworze nadają mu niebieską barwę. W wyniku reakcji jony miedzi przechodzą w miedź metaliczną, co powoduje zmniejszenie ich stężenia w roztworze, stąd jego utrata barwy.
W czwartej probówce obserwujemy odbarwienie roztworu. Jony żelaza (III) nadają żółtą barwę roztworom wodnym. Na skutek przechodzenia jonów żelaza (III) w żelazo metaliczne, ich stężenie w roztworze znacznie maleje, co objawia się odbarwieniem roztworu. Jony cynku, które przechodzą do roztworu nie nadają mu żadnej barwy.
Aktywność metali użytych do doświadczenia maleje w szeregu Zn>Fe>Cu>Ag – metal bardziej aktywny wypiera mniej aktywny metal z soli. Miejsce w soli to miejsce VIP 🙂
Subskrybuj nasz kurs chemii online, aby uzyskać dostęp do tego i wielu innych zadań z rozwiązaniami!